만성질환을 가진 환자들이 많은 경우에 공통적으로 호소하는 증상으로 소화불량, 속쓰림, 변비나 설사 등이 있다. 현대의학의 관점에서는 환자가 호소하는 증상을 억제해 주는 것에 주로 초점이 맞추어져 있고 속쓰림 증상이나 역류성 식도염 증상을 호소하면 위산을 없애는 방향으로 약물을 처방하는 경향이 있다. 하지만 만성 환자들은 오히려 만성적인 위산저하로 인하여 위에서 제거되어야 할 유해균들이 제거되지 못하고 소장으로 넘어가게 되어 장내 이상균의 증식증을 초래할 수 있다. 또한 입으로 섭취한 많은 필수 미네랄들이 위산에 의하여 이온화되어야 흡수될 수 있는데, 위산저하상태가 되면 이온화가 되지 않아서 잘 흡수되지 않을 수 있다.
그 결과 골다공증을 포함한 만성적인 영양 부족에 시달릴 수 있게 된다. 기능의학적으로 환자를 분석하고 평가해서 치료하는 의사들은 지금까지의 현대의학의 증상억제 치료가 결국은 질병의 예후를 악화시키고 있다는 것을 임상적인 경험으로 알게 되었으며, 이런 것들에 대한 여러 가지 객관적이 증거들이 속속 들어나고 있다. 이번 달부터는 이러한 관점에서 위장관의 생리학에 근거하여 만성 난치병환자들을 치료함에 있어서 위장관의 건강관리가 중요한 이유를 찾아보도록 하겠다.
 위액의 분비에 대한 생리학
위액의 분비에 대한 생리학
위액은 대표적으로 5가지 정도를 함유하고 있다. 내재성인자(intrinsic factor, IF), 수소이온, 펩신(pepsin), 점액 및 물 등이 있다. 이것들은 위 점막 안에 있는 다양한 세포들에서 분비된다. 내재성 인자는 비타민 B12와 결합하여 회장(ileum) 말단의 점막에서 흡수된다. 비활성 상태의 효소인 pepsinogen이 위산에 의하여 pepsin으로 활성화 된다. pepsin이 부족하면 모든 단백질을 분해 및 소화를 시킬 수 없기 때문에 대변에서 질소화합물이 잘 검출되지 않는다. 위산은 또한 음식물과 같이 들어온 많은 균들을 사멸시킴으로서 소장에 도달하는 균의 수를 감소시킨다. 위산의 분비가 심하게 감소되거나 분비가 안 되면 위장관의 감염증이 증가된다. 위벽의 점막을 싸고 있는 점액은 위벽을 손상으로부터 보호한다. 점액은 일차적으로 윤활유 역할을 하여 기계적인 자극에서 위벽을 보호한다. 점액은 중탄산염(HCO3-)과 같이 위산을 중화하여 점막의 표면의 산성도를 중성으로 유지하게 해준다. 이것들이 위 점막의 보호막역할을 한다.
기능 해부학
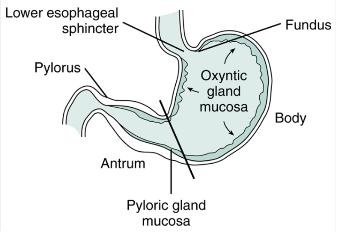
기능적으로 위 점막을 분류해 보면 oxyntic gland area (산분비성 선 영역)와 pyloric gland area(유문 선 영역)로 나눌 수 있다(그림 1. 참조). oxyntic gland의 점막은 위산을 분비하고 이것은 위(stomach)의 근위부 80%에 해당된다. 즉 oxyntic gland area는 위체부(body)와 기저부(fundus)를 포함한다. 아래쪽의 나머지 20%인 pyloric gland area는 가스트린(gastrin)을 합성하며 이곳은 전정부(antrum)로 연결되어 있다.
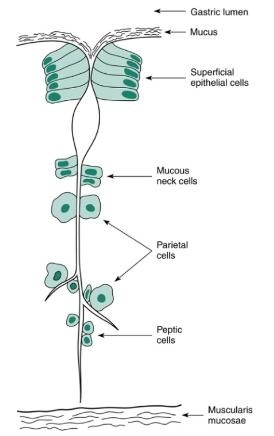 위 점막은 pits(깊은 구덩이)와 glands로 구성되어 있는데(그림 2. 참조) pits와 표면 자체는 점액이나 표면 상피세포로 lining되어있다. pits의 기저부는 glands쪽으로 개구되어 있다. oxyntic glands는 산을 분비하는 벽세포(parietal cells)와 pepsinogen을 분비하는 chief cells(=peptic cells) 등으로 구성된다.
위 점막은 pits(깊은 구덩이)와 glands로 구성되어 있는데(그림 2. 참조) pits와 표면 자체는 점액이나 표면 상피세포로 lining되어있다. pits의 기저부는 glands쪽으로 개구되어 있다. oxyntic glands는 산을 분비하는 벽세포(parietal cells)와 pepsinogen을 분비하는 chief cells(=peptic cells) 등으로 구성된다.
유문부(pyloric gland)의 분비선은 가스트린을 분비하는 G세포 및 pepsinogen을 분비하는 점액세포(mucous cells)를 포함하고 있다. mucous neck 세포들은 pits쪽으로 개구부를 내고 있다. 이러한 세포들은 줄기세포를 가지고 있기 때문에 지속적으로 세포분열이 일어난다. 새롭게 분열된 세포들은 표피 쪽으로 이동하여 점액세포로 분화되고 gland의 아래쪽으로 자라나는데, 이것들은 oxyntic gland area에서는 벽세포가 된다. 내분비 세포인 G세포 또한 줄기세포로부터 분화된다. peptic 세포들도 세포분열을 할 수는 있으나 점막이 손상된 경우에는 줄기세포로부터 분화된다. gland에 있는 세포보다는 표면이나 pits에 있는 세포들이 좀 더 빠르게 새로운 세포로 교체된다.
벽세포는 위산(HCl)을 분비하고 인간에서는 intrinsic fac-tor도 분비한다. 다른 동물에서는 chief cell도 intrinsic factor를 분비한다. 정상적인 인간의 위에는 약 10억 개의 벽세포가 있으며, 150~160mEq/L정도의 농도를 가진 위산을 분비한다. 벽세포의 숫자가 위산의 최대 분비능력을 결정지으며 각 개인마다 차이를 보인다. 인간의 위는 하루에 1~2liter의 위액을 분비한다. 혈액의 pH는 7.4정도인데 위산의 pH를 1~2정도 유지하려면 수백만 배의 농도차이를 유지해야하기 때문에 많은 ATP에너지를 사용해야 한다. 그래서 벽세포에는 많은 수의 미토콘드리아를 함유하고 있다(그림 3. 참조).
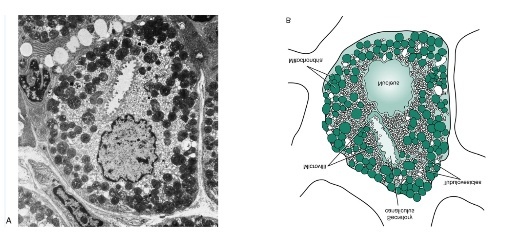 휴식상태에서는 벽세포의 세포질에는 tubulovesicles이 많이 존재한다. 이것은 또한 세포내 미소관(intracellular can-aliculus)에 의하여 oxyntic gland의 lumen으로 연결 되어있다. tubulovesicles은 위산을 생산하고 분비에 필요한 효소들인 carbonic anhydrase(CA), H+,K+-ATPase를 가지고 있다. 그러므로 자극이 없는 휴지기의 벽세포에서는 위산이 벽세포내의 tubulovesicles내에 모여서 보관되어 있다가 위산을 분비하라는 신호가 오게 되면 10분 이내에 tubulovesicles이 벽세포의 세포막 쪽으로 이동하여 위산을 lumen쪽으로 분비하게 된다. 위산의 분비가 끝나면 tubulovesicles은 처음상태로 재구성되어 휴지기 상태로 들어가게 된다.
휴식상태에서는 벽세포의 세포질에는 tubulovesicles이 많이 존재한다. 이것은 또한 세포내 미소관(intracellular can-aliculus)에 의하여 oxyntic gland의 lumen으로 연결 되어있다. tubulovesicles은 위산을 생산하고 분비에 필요한 효소들인 carbonic anhydrase(CA), H+,K+-ATPase를 가지고 있다. 그러므로 자극이 없는 휴지기의 벽세포에서는 위산이 벽세포내의 tubulovesicles내에 모여서 보관되어 있다가 위산을 분비하라는 신호가 오게 되면 10분 이내에 tubulovesicles이 벽세포의 세포막 쪽으로 이동하여 위산을 lumen쪽으로 분비하게 된다. 위산의 분비가 끝나면 tubulovesicles은 처음상태로 재구성되어 휴지기 상태로 들어가게 된다.
점액세포의 표면 상피세포는 세포의 첨단부위에 많은 점액과립을 가지고 있다. 분비가 시작되면 과립의 막이 세포막과 융합이 일어난 후 lumen으로 점액이 분비된다. Peptic 세포는 pepsinogen의 합성을 위하여 소포체(endoplasmic reticulum)가 매우 발달되어 있다. 효소의 전단계 물질인 proenzyme이 세포질내의 Golgi 복합체에 효소원(zymogen) 과립상태로 존재한다. zymogen과립은 세포의 첨부(apical portion)로 이동한 후, 분비될 때 세포외 유출(exocytosis)에 의하여 lumen으로 방출된다.
소화기에서 내분비 기능을 하는 세포들도 많은 과립을 가지고 있는데, peptic 세포와 점액세포와는 달리 호르몬을 가지고 있는 과립들은 세포의 기저부에 위치한다. 이러한 호르몬들은 세포 사이의 공간(intercellular space)으로 분비되기 때문이다. 내분비 세포들은 많은 미세융모(microvilli)를 가지고 있는데 이것들은 첨단부위에서 lumen까지 연장되어있다. 미세융모는 아마도 lumen의 내용물을 감지할 수 있는 수용체를 가지고 있을 것으로 추정되며, 적절한 자극에 대한 반응으로 호르몬을 분비한다.
위산의 분비
위산을 분비하는 정확한 생화학적 기전과 단계는 완벽히 밝혀지지는 않았다. 그러나 이러한 반응을 간단히 요약하면 다음과 같다.
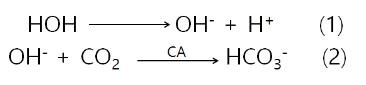
수소이온(H+)은 lumen으로 능동적으로 내보내지고 중탄산염(HCO3-)은 혈액으로 확산되어 흘러나간다. 그 결과 위에서 흘러나온 정맥혈은 위에서 산이 분비되는 동안에는 동맥혈보다 pH가 높아진다. 2단계는 탄산 탈수소효소(carbonic anhydrase, CA)에 의하여 촉매작용이 일어난다. 이 효소를 억제하면 분비되는 속도는 감소되지만 산의 분비를 막지는 못한다. 대사결과 많은 양의 이산화탄소(CO2)가 만들어져서 수산화이온(hydroxyl, OH-)을 중화시키는데 이용된다. 그러나 분비가 많아지면 혈액으로부터 이산화탄소(CO2)를 공급받아야 한다. 수소이온(H+)이 점액세포의 세포막을 능동적으로 이동(active transport)하기 위해서는 H+,K+-ATPase에 의하여 촉매작용이 일어나야 하고, 수소이온이 lumen으로 내보내지면서 칼륨이온(K+)과 교환이 일어난다. 세포내에서는 (Na+),K+-ATPase에 의하여 기저외측의 세포막에 칼륨이온이 축척된다. 축척된 칼륨이온은 전기화학적 경사를 따라서 이동하게 되기도 하고 세포막을 가로 질러서 새는 경우도 있다. 그러므로 lumen의 칼륨이온은 H+,K+-ATPase에 의하여 재활용된다.
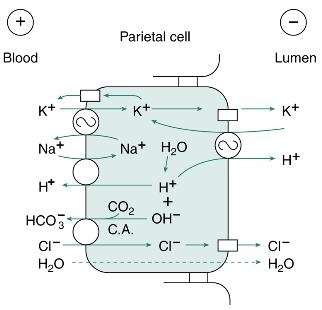 염소이온(Cl-)은 세포의 기저외측의 세포막을 가로질러서 세포 안으로 들어가서 중탄산염(HCO3-)과 교환이 일어난다. 수소이온을 세포 밖으로 퍼냄으로서 수산화이온(hydroxyl, OH-)이 되고, CO2로부터 carbonic anhydrase가 촉매작용을 하여 중탄산염(HCO3-)을 생성한다. 혈액 안으로 들어간 중탄산염은 혈액의 pH를 증가시킨다(그림 4. 참조).
염소이온(Cl-)은 세포의 기저외측의 세포막을 가로질러서 세포 안으로 들어가서 중탄산염(HCO3-)과 교환이 일어난다. 수소이온을 세포 밖으로 퍼냄으로서 수산화이온(hydroxyl, OH-)이 되고, CO2로부터 carbonic anhydrase가 촉매작용을 하여 중탄산염(HCO3-)을 생성한다. 혈액 안으로 들어간 중탄산염은 혈액의 pH를 증가시킨다(그림 4. 참조).
전기적 전위차가 만들어 지는 기전
휴지기에 oxyntic gland가 위치한 점막의 전위차는 -70 에서 -80 millivolts(mV)정도로 혈액에 비하여 lumen이 음전위를 나타낸다. 이러한 전위 차이는 주로 전기화학적 경사도에 대항하는 염소이온의 분비에 의하여 일어난다. 이러한 현상은 표피상피세포 및 벽세포에서도 일어난다. 위산 분비의 자극이 오면, 양전위를 나타내는 수소이온이 염소이온과 같이 이동하기 때문에 전위차는 -30 -40 mV 정도로 감소된다. 그러므로 수소이온은 실제적으로 전위 차이를 따라 분비된다. 그 결과 수백만 배의 농도차이를 역행해서 이동할 수 있다.
전기적 전위차를 만들고 수소이온의 수백만 배의 농도차이를 만들기 위해서는 점막으로 이온과 산의 유출현상을 최소화 해야만 한다. 이러한 유출현상을 예방하는 역할은 소위 위점막의 방어막(gastric mucobal barrier)이 담당한다. 아스피린 같은 약, 술이나 특정한 약물 등에 의하여 이러한 방어막이 손상을 받으면 이온의 유출현상이 생겨서 전기화학적 전위차가 내려가면서 전위 차이가 감소하게 된다. 그러나 방어막의 정확한 성격을 잘 알지는 못한다. 위를 가로지르는 음전위의 차이에 의하여 산의 분비가 가능하게 된다. 왜냐하면 수소이온이 전위 차이를 따라 분비되기 때문이다. 이러한 전위차는 전극을 위속에 삽입하였을 때 oxyntic gland의 점막은 식도(전위차: -15 mV) 혹은 십이지장(전위차: -5 mV)과의 전위차가 뚜렷하기 때문에 쉽게 감별할 수 있다.
위액의 전해질들
위액에서 주요전해질의 농도는 다양하나 주로 위액의 분비 속도와 관련성이 있다(그림 5. 참조). 낮은 속도로 분비될 때는, 최종적인 위액에는 필수적으로 염화나트륨의 용액과 소량의 수소이온과 칼륨이온이 존재한다. 분비속도가 증가하면 나트륨이온은 감소하고 수소이온은 증가한다. 이때 분비속도가 증가하면서 염소이온와 칼륨이온의 농도는 약간 증가한다. 최고 속도가 되면 위액은 주로 염산이 분비되면서 소량의 나트륨이온과 칼륨이온이 분비된다. 위액의 분비속도에 상관없이 수소이온, 칼륨이온 및 염소이온의 농도는 혈장보다는 높고 나트륨이온의 농도는 혈장보다는 낮다. 그러므로 분비 속도와 무관하게 위액과 혈장은 거의 isotonic하다.
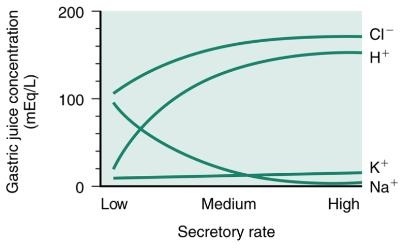 위액을 parietal component와 nonparietal component의 두개로 구분된 분비물의 혼합체라고 가정하면 이온의 농도의 변화를 쉽게 이해될 수 있다. nonparietal component는 일정하고 적은 양으로서 기저량의 알칼리를 분비한다. 주된 성분은 혈장과 동일한 농도의 나트륨이온, 염소이온 및 칼륨이온을 함유하고 있다. 수소이온의 분비가 없을 때 중탄산염(HCO3-)은 위액에서 검출될 수 있다. 중탄산염은 약 30 mEq/L의 농도로 분비된다. nonparietal component는 항상 존재하며 parietal component는 환경의 변화에 대항하여 분비된다. 분비속도가 증가되고 그 증가가 전적으로 parietal component에 의하여 증가되면 위액에서 최종 전해질의 농도는 순수한 벽세포의 분비물과 비슷해진다. 순수한 벽세포의 분비물은 약간 고삼투압(hyperosmotic)을 보이고 150~ 160mEq/L의 수소이온농도와 10~20mEq/L의 칼륨이온농도를 함유하고 있다. 이때 존재하는 유일한 음이온은 염소이온이다.
위액을 parietal component와 nonparietal component의 두개로 구분된 분비물의 혼합체라고 가정하면 이온의 농도의 변화를 쉽게 이해될 수 있다. nonparietal component는 일정하고 적은 양으로서 기저량의 알칼리를 분비한다. 주된 성분은 혈장과 동일한 농도의 나트륨이온, 염소이온 및 칼륨이온을 함유하고 있다. 수소이온의 분비가 없을 때 중탄산염(HCO3-)은 위액에서 검출될 수 있다. 중탄산염은 약 30 mEq/L의 농도로 분비된다. nonparietal component는 항상 존재하며 parietal component는 환경의 변화에 대항하여 분비된다. 분비속도가 증가되고 그 증가가 전적으로 parietal component에 의하여 증가되면 위액에서 최종 전해질의 농도는 순수한 벽세포의 분비물과 비슷해진다. 순수한 벽세포의 분비물은 약간 고삼투압(hyperosmotic)을 보이고 150~ 160mEq/L의 수소이온농도와 10~20mEq/L의 칼륨이온농도를 함유하고 있다. 이때 존재하는 유일한 음이온은 염소이온이다.
위액 분비에 있어서 두 가지 구획 모델은 실제 인체에서 일어나는 일과 비교해서 너무 단순화한 경향이 있다. 벽세포의 분비는 위액이 gland에서 lumen으로 이동하면서 나트륨이온과 수소이온의 교환이 일어나면서 약간 변형된다. 이러한 변화는 그다지 크지는 않지만 분비의 속도가 낮은 경우에 주로 일어나는 현상이다. 그 결과 위액에서 최종적으로 이온의 조성을 결정하는데도 관여한다.
만성적인 구토환자나 위액을 흡입하고 정맥주사로 치료하는 환자에서는 위액의 구성성분을 아는 것은 매우 중요하다. 염화나트륨과 포도당이 들어있는 수액만을 투여하는 것은 칼륨이 부족한 대사성 알칼리 혈증을 만들어서 환자에게는 치명적일 수 있다.
위산의 분비를 자극하는 것들 Stimulants of Acid Secretion
소수의 몇 가지 물질만이 직접적으로 벽세포가 위산을 분비할 수 있게 한다. 전정부 호르몬인 가스트린과 부교감 신경에서 분비되는 아세틸콜린이 가장 중요한 생리적 조절자이다. 아세틸콜린은 가스트린분비를 자극할 뿐 아니나 벽세포를 직접 자극한다.
최근까지 장에서 만들어지면서 잘 알려져 있지 않은 여러 호르몬이 위산의 분비를 자극한다는 많은 증거들이 보고되고 있다. 이러한 물질들을 잠정적으로는 유래한 장소와 기능을 고려해서 entero-oxyntin이라고 부르고 있다. 인간에서는 순환하는 아미노산도 벽세포를 자극할 수 있으며, 소장에 음식물이 있을 때도 벽세포를 자극한다.
위장관을 포함한 많은 조직에서 만들어지는 히스타민도 강력하게 벽세포의 분비를 자극하는 물질이다. 대부분의 포유류에서 히스타민의 분비는 가스트린에 의하여 조절되고 결국 가스트린과 아세틸콜린이 하듯이, 순서대로 위벽세포에서 위산의 분비를 촉진시킨다.
<다음 호에 계속>

