최 세 환 (崔世煥) spinexp@gmail.com
서울성모신경외과의원 원장 (암, 만성병 및 난치병 클리닉),
대한신경외과학회 상임이사, 대한신경외과의사회 부회장,
대한성장의학회 부회장, 대한비타민 C 암연구회 부회장,
대한제암거슨의학회 임상학술부회장, 대한정주의학회 회장,
미국 기능의학회(IFM) 정회원
 위산분비의 억제
위산분비의 억제
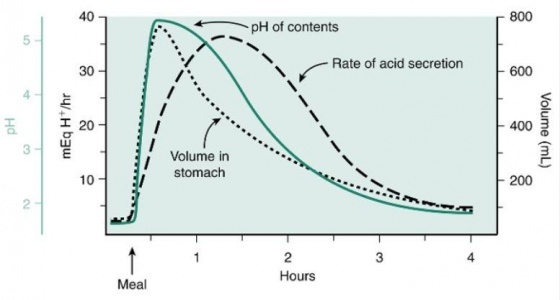
음식이 위속으로 들어가면 이미 먼저 있던 소량의 위산을 중화시킨다. 음식물이 내려가면서 전정부의 pH가 3.0이하로 내려가게 되면 gastric 및 cephalic phase를 자극에 의하여 가스트린이 분비된다. 음식을 섭취한 후 1시간이 되면 위산분비 속도는 최고로 올라가고 음식의 위산에 대한 완충효과도 포화상태에 이르게 되어 대부분의 음식은 십이지장으로 내려가게 된다. 그 결과 위속의 산의 농도가 증가되게 된다. 전정부의 pH가 다시 떨어지면 가스트린의 분비가 억제되고 위산의 분비를 자극하는 요소가 없어진 상태가 된다. 수동적인 음성 되먹임 기전은 위산의 분비를 조절하는데 있어서 매우 중요하다. 부가적으로 위속의 pH가 감소되면서 분비되는 somatostatin은 또한 직접적으로 위벽세포에서의 위산의 분비를 억제하고 ECL세포에서 히스타민의 분비를 억제한다. 위산의 분비속도와 pH 및 위속의 내용물의 양과의 관계는 그림 11에 잘 정리되어 있다.
위산의 분비를 억제하는 기전에 관여하는 몇 가지 호르몬들이 알려져 있는데, 이러한 호르몬은 위산, 지방산이나 고삼투압의 용액에 의하여 자극되어 십이지장의 점막에서 분비된다. 이러한 호르몬들을 포괄적으로는 enterogastrone이라고 부르는데 소화관 호르몬중의 하나이다. 이것들은 위에서 음식물을 십이지장으로 내려 보내는 역할뿐만 아니라 위산의 분비를 억제한다. 합목적적으로 보면 이러한 기전은 위의 내용물을 소장에서 소화하고 흡수하는 능력을 초과하지 않게 이동시키는 역할을 하게해준다. 또한 이러한 기전은 위산과 고삼투압의 용액에 의한 십이지장 점막의 손상을 예방해준다.
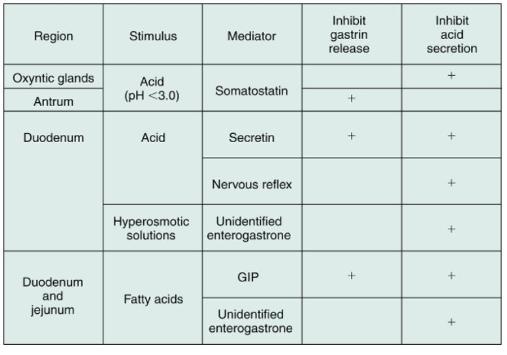 Gastric inhibitory peptide(GIP)는 지방산에 의하여 분비되고 위벽세포에 작용하여 위산의 분비를 억제한다. Secretin도 위산의 분비를 억제하기 때문에 또한 entero-gastrone의 한 종류로 분류될 수 있다. 이러한 효과에 대한 중요성과 생리학적 의의는 인간에서는 아직 완전히 밝혀지지 않았다. Cholecystokinin (CCK)은 위에서 십이지장으로 음식물을 내려 보내는 것을 생리적으로 억제하는 중요한 역할을 한다. 고삼투압 용액은 아직까지는 확인되지 않는 enterogastrone을 분비시킨다. 또한 위산은 십이지장의 점막에 있는 수용체를 자극해서 위산의 분비를 억제하는 신경반사를 촉진한다는 강력한 증거가 있다. 이러한 기전은 표 1 에 정리되어 있다.
Gastric inhibitory peptide(GIP)는 지방산에 의하여 분비되고 위벽세포에 작용하여 위산의 분비를 억제한다. Secretin도 위산의 분비를 억제하기 때문에 또한 entero-gastrone의 한 종류로 분류될 수 있다. 이러한 효과에 대한 중요성과 생리학적 의의는 인간에서는 아직 완전히 밝혀지지 않았다. Cholecystokinin (CCK)은 위에서 십이지장으로 음식물을 내려 보내는 것을 생리적으로 억제하는 중요한 역할을 한다. 고삼투압 용액은 아직까지는 확인되지 않는 enterogastrone을 분비시킨다. 또한 위산은 십이지장의 점막에 있는 수용체를 자극해서 위산의 분비를 억제하는 신경반사를 촉진한다는 강력한 증거가 있다. 이러한 기전은 표 1 에 정리되어 있다.
펩신
펩시노겐은 위의 pH가 5이하로 떨어지면 위액 속에서 펩신으로 전환된다. 펩신 자체는 부가적으로 스스로 다른 펩시노겐을 펩신으로 전환되는 것을 촉매할 수 있다. 펩신은 펩타이드의 내부 연결구조를 잘라줌으로서 단백질의 소화를 시작되게 해준다. 펩시노겐은 I과 II의 두 종류가 있는데, 펩시노겐 I은 oxyntic gland의 peptic and mucous 세포에서 분비되고 펩시노겐 II는 oxyntic gland 영역뿐만 아니라 pyloric gland와 십이지장의 점액세포(mucous cell)에서 분비된다. 펩시노겐은 혈액에서 검출가능하고 그 농도는 십이지장의 궤양형성과 연관성이 있는 것으로 알려져 있다. 가장 강력하게 펩시노겐의 분비를 자극하는 것은 아세틸콜린이다. Cephalic 과 gastric phase때 미주신경의 자극은 펩시노겐의 분비의 총량에 상당한 영향을 준다. 수소이온은 펩신의 생리학적인 관점에서 보면 몇 군데에서 중요한 역할을 한다. 첫 번째로, 위산은 펩시노겐을 펩신으로 활성화시키는데 필요하고 이러한 반응은 pH 2정도에서는 거의 즉각적으로 일어난다. 두 번째로, 위산은 국소적인 콜린반사를 일으켜서 chief세포의 분비를 자극한다. 이러한 기전은 아트로핀에 민감하며 위산과 펩신의 분비와 밀접한 상관관계가 있다. 세 번째로, 위산에 민감한 반사는 다른 자극들에 의한 효과가 펩신을 분비하는 세포에 매우 강하게 나타나게 한다. 이러한 기전은 펩신으로 전환될 수 있는 위산이 충분하지 않으면 많은 양의 펩시노겐이 분비되지 않는다는 것을 뒷받침한다. 네 번째로, 위산은 십이지장 점막에서 secretin이라는 호르몬을 분비하게 한다. 비록 정상상태에서 secretin이 충분한지는 의문점이 있지만, 또한 secretin은 펩시노겐의 분비를 자극한다. 가스트린은 보통은 pepsigogue로 분류한다. 가스트린을 주사하면 펩신의 분비가 증가된다. 인간에서 가스트린은 약한 pepsigogue역할을 할 가능성이 있다. 펩시노겐의 분비를 조절하는 기전은 그림 12에 정리되어 있다. 펩신은 소위 소화성 궤양의 한 종류인 위십지장 궤양의 발생에서 중요한 역할을 한다. 펩신이 없으면 위산은 궤양을 만들지 않는다. 즉 궤양을 치료하는 동안에 위산의 분비를 억제하거나 위산을 중화시키는 것은 펩신의 분비를 억제하는 역할을 하는 것이다.
점액(Mucus)
부교감 신경의 자극과 아세틸콜린은 mucous neck 세포에서 용해성이 있는 점액의 분비를 증가시킨다. 용해성이 있는 점액은 점액단백질(mucoprotein)로 구성되어 있으며 위속의 chyme과 혼합되어 윤활작용을 한다. 표면 점액세포는 알코올 같은 화학적 자극제나 물리적 자극 혹은 음식물에 의한 마찰에 반응하여 육안으로 볼 수 있는 점액이나 비용해성의 점액을 분비한다. 육안에 보이는 점액은 겔형태로 분비되어 표피세포 분비물의 알칼리성 구성성분을 옭아맨다. 이것은 식간에 일어나며 윤활작용을 하는 알칼리 층이 점막을 보호한다. 이러한 보호막은 점액을 함유한 표피세표에 의하여 형성되고 이 보호막은 점액층에서 탈락되기도 하고 흡수되기도 한다. 음식을 먹는 동안에 비용해성의 점액은 점막을 물리적이고 화학적인 손상에서 보호한다. 이것들은 일정량의 위산을 중화하고 점막과 펩신의 접촉을 방해한다. 위산과 접촉했을 때 비용해성의 점액이 덩어리상태로 침착되고 chyme과 같이 십이지장으로 넘어간다.
내재성 인자(Intrinsic Factor)
내재성 인자는 점액단백질로 구성되어 있고 위벽세포에서 분비된다. 이것은 비타민 B12와 결합하여 복합체를 형성하여 회장말단부에서 흡수가 가능한 형태로 된다. 위의 무산증과 위벽세포가 없어지는 위축성 위염이 진행되면 내재성 인자의 분비가 안 되어 비타민 B12 결핍이나 악성빈혈이 발생된다. 간에는 수년간 사용할 수 있는 비타민 B12를 보유하고 있기 때문에 이러한 질병은 오랜 시간이 지나서야 인지되는 경우가 많다.
점막의 성장
위장 점막의 성장은 신경자극, 분비물 및 성장을 자극하는 기능이 있는 음식의 섭취, 소화와 관련된 여러 가지 요소들 및 소화기에서는 직접 분비되지 않는 여러 호르몬들의 영향을 받는다. 동물실험에서 뇌하수체를 제거하면 소화관의 점막과 췌장이 위축되는 결과를 초래하는 것이 관찰되었다. 이때 성장호르몬을 투여하면 위축을 예방할 수 있었다. 뇌하수체를 제거한 후에 가스트린을 투여하면 다른 조직의 성장에는 영향을 주지 않고 위장 점막 및 췌장 소화액 분비기능의 위축을 예방하였다. 흥미롭게도 부신피질호르몬이 출생 직후에 위장관의 발달에 영향을 줄 수 있다는 여러 가지 증거들이 있다.
가스트린은 위의 oxyntic gland 점막의 성장을 조절하는데 중요하며 필수적인 요소이다. 또한 가스트린은 소장과 대장 점막의 성장 및 췌장의 소화액 분비기능을 촉진한다. 사람에서 위의 전정부(antrum)를 절제하면 나머지 위점막의 위축이 일어난다. 쥐를 이용한 실험에서 위의 전정부를 절제하면 전정부와 식도를 제외한 모든 위장관의 점막에 위축이 일어났고 췌장의 소화액 분비기능이 감소되었다. 이러한 변화는 외부에서 가스트린을 투여하면 예방되었다. 혈중 가스트린이 증가하면 일차적으로 위벽세포 및 ECL세포가 증가된다. 가스트린은 CCK-2 수용체를 경유하여 ECL세포를 증식하는 강력한 자극제이다. 장기간 가스트린의 혈중 농도가 높아져 있으면 ECL세포의 과다형성(hyperplasia)이 일어난다.
예를 들면 중증 비만 치료를 위한 것이나 종양 제거를 위하여 소장의 일부를 잘라내면 나머지 점막이 적응하게 된다. 즉 전체 소화기관의 점막은 과다형성이 일어나서 소화 및 흡수 능력이 증가되고 위(stomach)의 경우는 위산의 분비가 증가된다. 소장을 잘라내면 가스트린의 분비를 증가시키지만 적응하는데 변화를 줄만큼 충분하지는 않다.
위장관내의 내용물이 점막에 노출이 증가되는 것이 중요한 역할을 한다고 알려져 있다. 소장의 근위부를 절제하고 나면 원위부의 정상적인 점막이 췌장효소, 담즙과 영양소에 과도하게 노출된다. 연구자들은 아직 발견하지는 못하였지만 담즙과 췌장효소는 적응이 가능하게 하는 성장인자를 가지고 있을 것으로 추측하고 있다. 원위부의 점막에서 영양소의 흡수가 증가되면 또한 성장이 증가될 수 있다. 이때 가스트린과는 다른 호르몬이 적응하는데 관여하는데, 글루카곤 유사 펩타이드(glucagon-like peptide, GLP)가 소장의 원위부에서 분비된다.
음식은 또한 성장에 필요한 여러 가지 polyamine을 가지고 있다. 가스트린과 같은 성장인자는 증식하는 세포에서 polyamine의 합성을 자극한다. 그러므로 음식을 섭취하여 위장관내에 polyamine이 증가되면 성장에 관여하는 호르몬 합성이 일어나기 때문에 음식물에 변화를 주면 점막의 성장을 조절할 수 있다.
위십이지장 궤양은 소화성 궤양질환의 한 종류이다. 물론 두 가지 종류의 궤양이 발생하려면 위산과 펩신이 존재해야 하지만 두 가지 궤양은 근본적으로는 스스로를 보호하고 손상 받은 세포를 재생하는 기능이 떨어지면서 발생한다. 위궤양의 경우는 위점막의 손상에 대한 견뎌내는 능력에 결함이 있어서 발생하지만 십이지장궤양은 증가된 위산과 펩신에 점막이 노출되어 생긴다. 이러한 분석은 너무 단순화 했지만 이러한 것은 의심할 여지없이 궤양의 모든 경우에서 중요한 요소이다.
| 참고 범위 | ||
| 상태 | Basal Acid output(mEq/hour) | Maximal Acid Output(mEq/hour) |
| 정상 | 1-5 | 6-40 |
| 위궤양 | 0-3 | 1-20 |
| 악성빈혈 | 0 | 0-10 |
| 십이지장 궤양 | 2-10 | 15-60 |
| Zollinger-Ellison 증후군(Gastrinoma) | 10-30 | 30-80 |
표 2. 사람의 위에서 질병에 따른 위산의 분비능력의 비교
정상인과 위장관 질환이 있는 환자에서 위산의 분비량은 표 2에 잘 정리되어 있다. 최대 위산 분비능력은 가끔 측정하지만 그 자제가 궤양성 질환을 진단하는 데에 있어서의 가치는 그리 높지 않다. 정상인에서는 히스타민, betazole이나 가스트린을 주사하였을 때 시간당 약 25mEq정도의 수소이온이 분비된다. 십이지장 궤양환자에서는 평균적으로 시간당 약 40mEq정도의 수소이온이 분비되지만 그 정도가 개인차에 따라 심해서 진단적 가지는 적다. 가장 위산을 많이 분비하는 경우는 gastrinonoma(Zollinger-Ellison 증후군)에서 볼 수 있지만 위산의 분비정도의 검사결과로만 감별하기는 불가능하다. 예를 들면, 위궤양의 경우에는 정상범위보다 위산의 분비가 적어도 생길 수 있고 위암의 경우에는 위산의 분비능력이 낮은 경우가 많다. 그리고 많은 위궤양과 위암환자에서 위산의 분비 정도는 정상범위에 있다는 사실이다.
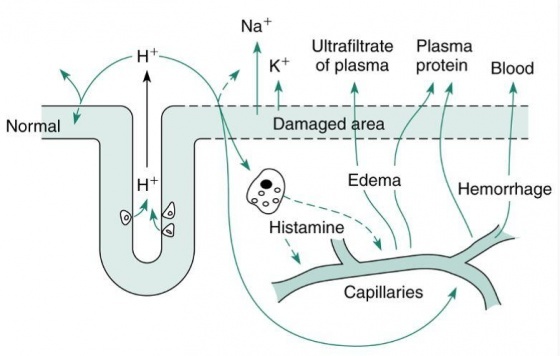
유문부에서 산이 많아지면 가스트린의 분비를 억제하는 음성되먹임 기전이 있기 때문에, 일반적으로 말하면 혈중 가스트린의 농도와 위산의 분비능력사이에는 반비례 관계에 있다. 위궤양이나 위암환자는 보통은 정상보다 높은 혈중 가스트린 농도를 보인다. Zollinger-Ellison증후군에서 혈중 가스트린이 높은 이유는 이러한 음성되먹임 기전이 작동하지 않는데, 그 이유는 가스트린이 유문부에서 분비되는 것이 아니고 위산에 의하여 억제되지 않는 종양자체에서 분비되기 때문이다. 결론적으로 말하면 혈중 가스트린 농도는 위산에 이상이 오는 다양한 질환을 감별하는데 적용하기는 쉽지 않다. 위궤양에서 위산의 분비가 감소되는 경우는 부분적으로 위산을 분비하는 조직이 치유되는 것이 실패하고 위산이 거꾸로 손상된 위 점막을 가로질러서 새는 현상이 일어나면서 발생된다고 생각된다. 위점막의 장벽(barrier) 개념은 그림 13에 도식화 되어 있다.
임상적 적용
정상적인 위점막은 상대적으로 수소이온이 통과하지 못한다. 위점막의 장벽(barrier)이 약해지거나 손상을 받으면 수소이온이 점막쪽으로 새게 되면서 나트륨이온과 교환이 일어난다. 수소이온이 점막에 축척되기 시작하면 세포내의 중화시스템이 포화되고 세포내의 pH가 감소되게 된다. 그 결과 세포가 손상을 받거나 죽게 된다. 그리고 칼륨이온이 손상된 세포에서 위의 내강으로 유출된다. 수소이온은 점막의 비만세포(mast cell)에 손상을 줌으로서 히스타민을 분비하여 점막의 모세혈관에 있는 H1 수용체에 작용하여 증상을 더욱 악화시킨다. 그 결과 국소적인 허혈증, 저산소증 및 혈액의 저류가 발생된다. 혈장내의 단백질과 펩신이 위액으로 유출되며, 손상이 심한 경우에는 출혈이 동반될 수 있다. 흔히 점막에 손상을 주는 물질은 아스피린, 알코올 및 담즙염 등이 있다. 위벽의 장벽(barrier)의 국소적 손상에 의한 점막의 병변은 위궤양의 전단계 소견이 될 수 있다.
장벽(barrier)의 정확한 본성은 잘 알려져 있지 않지만 아마도 여러 가지 생리학적 및 해부학적 특징을 가지고 있다고 알려져 있다. 세포막과 세포연접복합체(junctional complex)는 일단 분비된 수소이온이 정상적으로는 역으로 확산되는 것을 방지한다. 정상적으로 분비된 수소이온은 위의 내강으로 운송된다. 점막이 위산에 대한 손상을 방지하고 정상적인 상태를 유지하기 위해서는 혈류, 점액, 탄산수소염의 분비, 세포의 재생 및 가스트린, 프로스타글란딘, 상피성장인자(epidermal growth factor)같은 화학적 인자들이 중요한 역할을 한다. 방금 언급한 세 가지 화학적 인자들은 위궤양의 중증도를 감소시키고 치유를 촉진하는 역할을 한다.
 십이지장 궤양의 발생에 영향을 미치는 중요한 인자는 위산과 펩신의 분비정도이다. 십이지장 궤양환자는 평균적으로 20억 개의 위벽세포를 가지고 있으며 시간당 40mEq의 수소이온을 분비한다. 이 숫자는 정상인과 비교하면 약 50%정도가 된다. 부가적으로 십이지장궤양에서는 펩신이 두 배로 분비되는데 이것은 혈중 pepsinogen을 측정함으로 알 수 있다. 십이지장 궤양환자는 공복에서 혈중 가스트린의 농도는 비록 정상이지만, 음식물을 섭취한 후 가스트린 분비와 가스트린에 대한 감수성은 증가되어있다. 정상인보다 십이지장 궤양환자에서 식사 후 혈중 가스트린이 증가하는 것은 부분적으로는 위산이 가스트린의 분비를 억제하는 효율이 떨어지기 때문이다. 그러므로 벽세포의 수가 증가하는 것은 가스트린에 의한 영양효과(trophic effect)때문이라고 추정된다.
십이지장 궤양의 발생에 영향을 미치는 중요한 인자는 위산과 펩신의 분비정도이다. 십이지장 궤양환자는 평균적으로 20억 개의 위벽세포를 가지고 있으며 시간당 40mEq의 수소이온을 분비한다. 이 숫자는 정상인과 비교하면 약 50%정도가 된다. 부가적으로 십이지장궤양에서는 펩신이 두 배로 분비되는데 이것은 혈중 pepsinogen을 측정함으로 알 수 있다. 십이지장 궤양환자는 공복에서 혈중 가스트린의 농도는 비록 정상이지만, 음식물을 섭취한 후 가스트린 분비와 가스트린에 대한 감수성은 증가되어있다. 정상인보다 십이지장 궤양환자에서 식사 후 혈중 가스트린이 증가하는 것은 부분적으로는 위산이 가스트린의 분비를 억제하는 효율이 떨어지기 때문이다. 그러므로 벽세포의 수가 증가하는 것은 가스트린에 의한 영양효과(trophic effect)때문이라고 추정된다.
위십이장궤양의 주된 후천적인 요소는 헬리코박터 파일로리균에 의한 감염이다. 아스피린이나 NSAIDs를 장기간 사용해서 발생한 것을 제외하면 십이지장궤양환자의 80%와 위궤양환자의 거의 100% 환자에서 헬리코박터 파일로리균에 감염되어 있다. 헬리코박터 파일로리균은 그램 음성의 세균으로 요소가수분해효소(urease)의 활성도가 높아서 요소를 암모니아로 분해해서 위산을 중화시킨다. 그래서 이 세균은 위산의 환경에서도 살아남아서 군집을 이룰 수 있다. 이때 만들어진 암모니아 이온(NH4+)은 직접적으로 상피세포에 손상을 주고 점막의 장벽(barrier)에 손상을 줌으로서 점막의 투과도를 증가시키기 때문에 세포독성의 주된 원인이라고 추정된다. 또한 이 세균은 혈소판 활성화 인자 및 사이토카인 같은 많은 다른 요소들을 분비하여 세포에 손상을 준다. 이러한 많은 요소들이 관여하여 위궤양을 만든다고 추정된다. 헬리코박터 파일로리균에 의한 감염은 위염에서 시작해서 위암까지 진행할 수 있다.
NSAIDs는 cyclooxygenase효소를 억제하여 아라킨돈산에서 프로스타글란딘(PGE2 및 PGI2)의 합성을 감소시킨다. 프로스타글란딘은 정상적으로는 보호기능이 있고 증가된 아라키돈산은 leukotrien B4(LTB4)를 생산해서 중성백혈구가 점막의 모세혈관에 달라붙게 한다. 그 결과 혈액순환을 방해해서 허혈상태를 만들어서 점막에 손상을 준다.
헬리코박터 파일로리균은 또한 십이지장궤양에서 위산의 분비를 증가시키는 원인이 된다. 정상인과 비교해보면 십이지장궤양환자는 기저위산분비(basal acid output)가 증가되어 있고 gastrin-releasing peptide (GRP)에 의한 위산 분비도 증가되고, 가스트린에 의한 최대위산분비(maximal acid output)도 증가되며 가스트린이나 GRP에 의한 최대위산분비에 대한 기저위산분비의 비율도 증가된다. 가스트린에 의한 최대위산분비가 증가되는 것을 제외하고 이러한 모든 소견들은 헬리코박터 파일로리균을 제균하고 나면 모두 사라진다. 증가된 위산의 분비와 GRP에 대한 가스트린의 반응은 헬리코박터 파일로리균에 감염되어 분비되는 somatostatin에 의하여 가스트린의 방출과 위벽세포에서의 위산분비의 억제가 안 되는 것과 관련이 있다. 헬리코박터 파일로리균에 의한 위염은 위와 십이지장궤양에서 양상이 서로 다르다. 위궤양은 광범위한 위염과 관련이 있으나 십이지장궤양은 주로 유문분의 감염과 주로 연관성이 있다.
십이지장 궤양에서 약물 치료는 보통 제산제를 투여하여 산을 중화시키고 H2 수용체의 차단제를 투여하여 산의 분비를 억제시킨다. H+,K+-ATPase(proton pump) 억제제인 오메프라졸(omeprozole)은 모든 산의 분비를 차단한다. 이것은 십이지장궤양을 치료하는데 매우 효과적이며 Zollinger-Ellison증후군에서도 효과가 있다. 수술적 치료는 전적으로 생리학적인 것을 고려해서 시행하게 되는데, 가장 흔한 방법은 미주신경을 절제하고 유문부위를 수술로 적출하는 것이다. 이러한 수술은 위산을 분비하는 주된 구조물을 제거함으로서 위산의 분비를 60~70%정도 감소시킨다. H2 차단제과 프로톤 펌프 억제제가 도입되면서 수술적 치료의 빈도는 매우 감소하였다. 재발을 막기 위하여 헬리코박터 파일로리균을 제균하는 것이 매우 중요하다. 항생제과 omeprozole을 함께 투여 한 경우에 제균효과가 가장 좋았다.
지금까지 상부 위장관에서 위산의 분비와 조절이 균형에 대한 생리학적 관점과 대표적인 질병에 대한 병리학적 기전을 설명하였다. 최근까지의 주된 화두는 위염과 위십이지장궤양의 예방과 치료에 주로 치중하는 약물치료에 주로 집중하면서 오히려 위산저하에 대해서는 간과된 부분이 많이 있다. 만성적으로 위산저하가 지속되면 위에서 음식물과 같이 유입된 많은 병적 세균을 포함한 미생물들이 위산에 의하여 제거될 수 있는 기회를 잃게 되어 식중독, 과민성 대장염, 소장 세균의 과다증식증(SIBO, small intestinal bacterial overgrowth)등이 생길 수 있는 가능성이 높아진다. 뿐만 아니라 철, 구리, 마그네슘, 칼슘 등 +2가 이온의 미네랄 들이 염의 상태로 섭취한 후 위산에 의하여 이온화되어 흡수되어야 한다. 그러나 장기간의 제산제 사용이나 헬리코박터 파일로리 균의 감염이 만성화되어 생긴 위산저하에 의하여 이온화가 방해되어 만성적인 미량 미네랄의 결핍에 의한 에너지 대사의 불균형과 골다공증의 악화 뿐만 아니라 자가면역질환같은 많은 만성난치성 질환을 초래할 수 있다는 점을 간과해서는 안 될 것이라 사료된다.

