우리 몸을 구성하는 기관 중에서 대사적인 관점에서 매우 중요한 기관은 근육, 뼈 및 지방 등이다. 나이가 듦에 따라 보편적으로 나타나는 육체적 변화는 근골격계의 약화 및 복부비만을 포함한 체지방의 증가이다. 노인에서 체지방이 증가되면 대사질환의 위험성이 증가되고, 골격계가 약해지면서 골다공증 및 골절의 위험률이 증가된다. 그러나 나이가 들면서 자연적인 근육량 감소에 대한 생리학적 현상에 대하여 의학계에서 관심을 보이기 시작한 것은 그리 오래되지 않았다. 이런 원인은 근육 감소증에 대한 과학적 이해가 부족했을 뿐만 아니라, 전 세계적으로 통일된 진단 기준도 아직까지 합의되지 않았으며, 아직은 약물과 같은 확실한 치료방법이 없는 것이 원인이라고 생각된다. 총 인구 중에서 65세 이상의 고령자가 차지하는 비율이 7%가 넘으면 고령화 사회인데 우리나라는 이미 2000년에 고령화 사회가 되었고 2017년에는 14%가 넘게 됨으로서 고령사회에 접어들게 되었다.
근육 감소증(sarcopenia)은 그리스어에서 기원을 보면 근육을 의미하는 “sarco”와 감소되어 있다는 뜻의 “penia”가 합성된 단어로 노화와 연관된 근육량의 감소를 의미한다. 다만 여기에서 “근육(muscle)” 이란 골격근(skeletal muscle)을 의미하고 평활근(smooth muscle)과는 관계가 없다. 즉 근육 감소증은 주로 사지에 분포한 골격근의 감소(loss of skeletal muscle mass)를 의미한다. 근육 감소증은 악성종양의 말기 등에서 나타나는 현저한 근육소실 상태인 악액질(cachexia), 독감 등 급성질병으로 인한 근육소모(muscle wasting), 혹은 근육자체의 질병(primary muscle disease)과는 반드시 구별되어야 하는 개념으로 순전히 노화와 연관되어 나타나는 점진적인 골격근 감소의 결과로 보아야 한다.
이와 같이 65세 이상의 고령의 연령층이 가파르게 증가하면서 골다공증과 근육 감소증의 유병률도 빠르게 증가되고 있다. 근육량의 점진적인 감소는 40대 이후부터 발생하여 70대까지 매10년마다 8%씩의 감소가 일어난다고 추정되며, 그 이후로는 더욱 급격한 감소가 발생하여 10년마다 15%까지 발생할 수 있다고 알려져 있다. 또한 하체 근력 저하도 70대까지는 10년마다 10~15%씩의 저하가 발생하며, 그 이후로는 10년마다 25~40%로 매우 빠르게 감소하게 된다. 이러한 근육 감소증은 사회적으로 노인 문제에 대한 관심이 증가할 뿐 아니라 경제적으로도 의료비용의 급증이 문제가 되고, 정치·사회적으로 복지문제라는 큰 테두리에서 매우 중요한 화두가 되었다. 많은 추적 연구를 통해서 노인에서 발생하는 생리적 변화는 다양하며, 일반적으로 연령이 증가함에 따라 근육량과 골밀도가 동시에 감소한다는 것이 밝혀졌다.
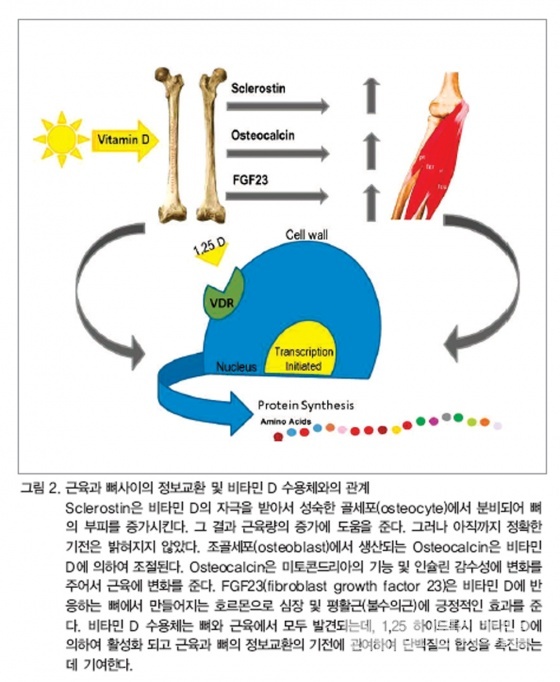
지금까지 골밀도가 감소되면서 생기는 골다공증과 골절에 대한 연구는 많이 되어 있었으나, 근육량이 감소되면서 발생하는 근육 감소증에 대해서는 그 중요성을 잘 모르고 있었다. 그러나 최근의 연구보고에 따르면 골다공증과 근육 감소증은 따로 떼어내서 별개의 질환으로 보기 보다는 하나의 개념으로 보면서 질병의 발생과 진행을 이해해야 할 것으로 사료된다. 그래야만 골다공증과 근육 감소증을 진단하고 치료방침을 세울 때 좀 더 체계적으로 접근할 수 있다(the concept of bone-muscle unit). 왜냐하면 뼈와 근육은 긴밀하게 신호를 서로 교환하면 항상성을 유지하기 때문이다. 근육에서 만들어 지는 secretome은 뼈에 영향을 주고, 조골세포와 골세포에서 생성되는 osteokine은 근육에 영향을 준다는 것이 밝혀졌다(그림 2 참조).
근육 감소증의 정의는 나이가 증가함에 따라 동반되는 근육의 양과 동시에 근력의 감소 및 기능이 떨어지는 것으로 정의되고 있다. 근육 감소증의 개념은 1989년 Irwin Rosenberg가 'sarcopenia'라는 말을 처음으로 도입하면서 시작되었고 근육 감소증의 임상적 진단 방법의 발달과 그 임상 결과가 알려지면서 근육 감소증에 대한 관심이 증가되고 있다. 그러나 보편적으로 이용되고 있는 골다공증 및 비만과 같이 표준화된 진단 기준이 아직은 없다는 것이 현실이다. 최초로 Baumgartner 등이 근육 감소증의 진단 기준을 제시한 이후, 다양한 연구가 이루어지고 있고 근육 감소증도 생리적 표현양상이 임상적으로 근력, 근육 단백질 역동학, 대사율 및 산화능력 등에 악영향을 미치며 체지방량을 증가시키고 일상생활 능력에 장애를 유발한다고 알려져 있다.
근육 감소증의 발생 기전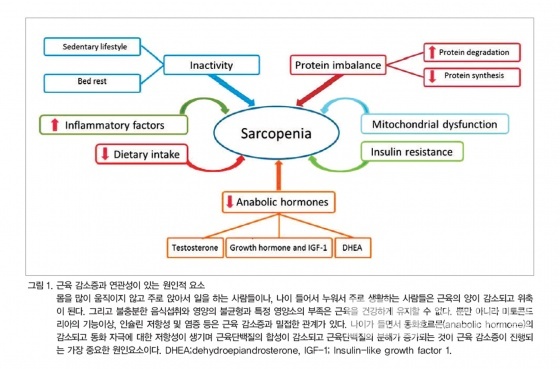
노인에서 근육 감소증에서 관찰되는 근육의 위축과 손실은 type II 근섬유의 감소와 연관 있다고 알려져 있다. 그러나 아직까지는 근육 감소증의 병리 생태는 확실하게 밝혀져 있지 않지만, 최근에 많은 연구결과들에 의하여 여러 가지 원인과 기전이 잘 설명되어 가고 있다(그림 1. 참조).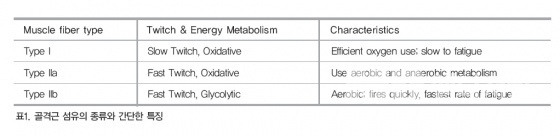
팔다리의 골격근(가로무늬근 또는 횡문근)은 근섬유(근세포)의 다발로 구성 되어 있고 근섬유는 느리게 수축하는 type I 과 빠르게 수축하는 type IIa, 및 IIb로 나뉜다(표 1 참조).
단백질 섭취와 근육량
노인의 근육량 감소는 부적절한 영양 섭취와 필수 아미노산과 같은 영양의 부족에 의한 것이 원인으로 알려져 있다. 한 단면 연구에서 70세 이상의 노인에서 단백질 섭취 권장량(0.8g/kg/day) 미만으로 단백질을 섭취하는 비율이 거의 40%였다고 보고되었으며, 또한 이러한 단백질 섭취량이 권장량 미만의 노인에서는 근육량과 근력에서 유의한 감소가 있었다. 일부의 연구에서 노인에서는 근육량의 감소를 막기 위해서는 단백질 섭취율을 권장량 이상으로 섭취할 필요가 있다는 보고도 있다. 우리나라에서도 2009년 국민영양통계에 따르면 65세 이상 남녀의 50%에서 한국인의 영양섭취기준 미만으로 단백질을 섭취하고 있다고 보고되었다. 단백질의 근간인 아미노산에 대한 근육의 반응은 아미노산의 종류나 나이와 관계없이 보존된다. 즉 아미노산을 정맥 투여하였을 때 나이와 관계없이 근육에서 단백질 합성이 증가된다는 것이 근조직 검사로 입증되었다. 또 다른 연구에서는 아미노산을 경구로 투여하면 연령과 관계없이 근육으로의 아미노산의 물질수송과 근육 단백질 합성이 증가하였고 이러한 변화는 균형 잡힌 아미노산 또는 필수 아미노산 투여군 모두에서 관찰되었다.
반면에 앞서 언급한 아미노산 단독만을 투여한 연구와 달리 다양한 영양분의 혼합물을 투여 한 여러 연구들에서는 근육량을 증가시킨다는 결과를 얻지는 못하였다. 그러나 단백질의 섭취가 근육 감소증에서 중요하지만 최근에는 동시에 섭취하는 영양분도 중요하다고 여겨지고 있다. 실제로 포도당과 아미노산의 혼합물을 같이 경구 투여하였을 때에는 젊은이와 노인 모두에서 근육의 분해가 감소되며, 근육으로의 아미노산 이동은 두 군에서 차이가 없었으나 근육의 합성은 젊은이에서만 일어나고 노인에서는 변화가 없었다. 따라서 젊은이와 달리 노인에서는 인슐린 저항성 때문에 고인슐린혈증에 대한 근육의 동화작용이 떨어짐으로서 근육 감소증이 발생하는 주요 원인으로 여겨지고 있다.
호르몬의 영향
 노화는 성장호르몬, IGF-1, 코티솔(cortisol), 남성호르몬(testosterone), 여성호르몬(estrogen) 등의 생산정도와 감수성(sensitivity)의 변화와 연관되어있다고 알려져 있다. 이러한 호르몬은 근육 단백질 대사의 동화 작용뿐만 아니라 이화작용에도 영향을 미치는 것으로 알려져 있다. 노인에서 흔히 관찰되는 성장호르몬 및 IGF-I의 감소는 내장 지방의 증가,근육량 감소 및 골밀도 감소와 연관 있다고 잘 알려 있다. 그러므로 성장호르몬 치료는 근육 감소증 환자에서 매력적인 치료법일 수 있으나 많은 연구에서 근육량은 증가하지만 실망스럽지만 근력의 증가는 보고된 바가 없다. 코티솔의 혈중 농도가 증가된 전형적인 고 코티솔 혈증의 대표질환인 쿠싱 증후군 환자에서도 역시 성장호르몬 및 IGF-I의 결핍 환자에서 관찰되는 근육량의 감소가 특징적으로 관찰된다. 과거의 연구에 따르면 노인에서는 아침 코티솔 농도에는 변화가 없으나 저녁 혈중 코티솔 농도가 증가된다는 사실이 알려졌다. 이러한 증가는 시상하부-뇌하수체-부신축(hypothalamo-pituitary-adrenal axis, HPA axis)의 불균형과 연관성이 있다고 추정된다. 이러한 불균형이 노인에서 상대적인 고 코티솔혈증이 근육 감소증의 원인중의 하나가 될 수 있다. 남성 호르몬인 테스토스테론은 단백질 이화 및 동화 경로의 활성뿐만 아니라 중배엽 줄기 세포가 지방 전구 세포로 분화되는 것을 억제하고 위성 세포(satellite cells)의 분화를 촉진한다고 알려져 있다. 남성에서 남성호르몬의 분비는 30세 이후부터 매년 1%씩 감소하며 이러한 변화와 근육량의 감소와 상대적으로 낮지만 근력의 감소와 평행한다고 알려져 있고 또 다른 연구에서는 저용량 테스토스테론 치료에서 근육량이 증가하고 고용량 테스토스테론에서는 근력이 증가한다고 보고된 바 있다.
노화는 성장호르몬, IGF-1, 코티솔(cortisol), 남성호르몬(testosterone), 여성호르몬(estrogen) 등의 생산정도와 감수성(sensitivity)의 변화와 연관되어있다고 알려져 있다. 이러한 호르몬은 근육 단백질 대사의 동화 작용뿐만 아니라 이화작용에도 영향을 미치는 것으로 알려져 있다. 노인에서 흔히 관찰되는 성장호르몬 및 IGF-I의 감소는 내장 지방의 증가,근육량 감소 및 골밀도 감소와 연관 있다고 잘 알려 있다. 그러므로 성장호르몬 치료는 근육 감소증 환자에서 매력적인 치료법일 수 있으나 많은 연구에서 근육량은 증가하지만 실망스럽지만 근력의 증가는 보고된 바가 없다. 코티솔의 혈중 농도가 증가된 전형적인 고 코티솔 혈증의 대표질환인 쿠싱 증후군 환자에서도 역시 성장호르몬 및 IGF-I의 결핍 환자에서 관찰되는 근육량의 감소가 특징적으로 관찰된다. 과거의 연구에 따르면 노인에서는 아침 코티솔 농도에는 변화가 없으나 저녁 혈중 코티솔 농도가 증가된다는 사실이 알려졌다. 이러한 증가는 시상하부-뇌하수체-부신축(hypothalamo-pituitary-adrenal axis, HPA axis)의 불균형과 연관성이 있다고 추정된다. 이러한 불균형이 노인에서 상대적인 고 코티솔혈증이 근육 감소증의 원인중의 하나가 될 수 있다. 남성 호르몬인 테스토스테론은 단백질 이화 및 동화 경로의 활성뿐만 아니라 중배엽 줄기 세포가 지방 전구 세포로 분화되는 것을 억제하고 위성 세포(satellite cells)의 분화를 촉진한다고 알려져 있다. 남성에서 남성호르몬의 분비는 30세 이후부터 매년 1%씩 감소하며 이러한 변화와 근육량의 감소와 상대적으로 낮지만 근력의 감소와 평행한다고 알려져 있고 또 다른 연구에서는 저용량 테스토스테론 치료에서 근육량이 증가하고 고용량 테스토스테론에서는 근력이 증가한다고 보고된 바 있다.
비타민 D는 골대사에서 중요한 역할을 하지만 근육 대사에서도 중요한 역할을 할 것으로 예상되고 있다. 여러 기전이 제시되고 있는데 비타민 D는 근육 세포내의 비타민 D 수용체와 결합하여 단백질 합성을 촉진시키고 세포막을 통한 칼슘 이동을 자극한다. 임상적으로 보면 비타민 D 결핍환자에서 흔히 근위부 근력 약화가 보고되고 있으며, 조직학적 소견에서는 type II 근섬유에서 주로 위축 소견이 관찰된다. 하지만 비타민 D가 직접적으로 근력을 상승시키는지는 불명확하지만, 몇몇의 연구에서 약간의 하지 근력 상승을 보고한 연구도 있다(그림 2 참조). 이상과 같이 노인의 근육 감소증에 관여되는 호르몬은 성장호르몬, IGF-1, 테스토스테론, 코티솔 및 비타민 D 등이 있다.
염증유발 사이토카인
In vitro 및 in vivo연구들에서 염증 유발 사이토카인(proinflammatory cytokines; TNF-α, IL-1 및 IL-6)은 근원섬유단백질(myofibrillar protein)의 분해를 촉진하고 단백질 합성을 감소시켜 직접적으로 근육 소모를 유발한다. TNF-α는 여러 세포내 인자들을 활성화시켜서 유비퀴틴 의존적 단백질 분해가 촉진 되도록 유도하고 세포 자멸사(apotosis)를 유도한다고 알려져 있다. 동물 실험에서 TNF-α 주입은 근육 위축을 유발하였으며, TNF-α 수용체 유전자가 제거된 형질변환 생쥐에 TNF-α를 분비하는 악액질(cachexia)의 암을 이식하면 정상 쥐에 비하여 근위축이 감소되었다. 세포 안에서는 TNF-α가 근아세포(myoblasts)에 작용하여 초기에는 유비퀴틴 의존적 단백질 분해가 유도되어 NF-κB의 활성화를 억제하여 근아세포의 세포자멸사를 방지하지만, 이후 지속적으로 TNF-α에 노출되면 NF-κB가 활성화 되어 결국 세포 자멸사도 활성화 된다.
그러나 악액질에서 보여 주었던 TNF-α의 역할 만큼 노화에서는 TNF-α의 역할은 뚜렷하지 않다. 그러나 나이가 증가함에 따라 세포자멸사를 촉진하는 TNF-α 신호 전달체계의 변화가 근육 감소증과 연관 있다고 알려져 있다. 특히 이러한 TNF-α 신호 전달체계의 변화는 근섬유의 종류에 따라 다르게 나타나는데, 특히 type II 섬유에서 보다 두드러지게 나타난다. 또한 IL-1와 IL-6 등 다른 염증 유발 사이토카인 역시 TNF-α와 같은 기전으로 동일한 영향을 주는 것으로 알려져 있다. 근육 감소증에서는 나이가 듦에 따라 내장 지방의 증가로 인한 복부비만과 이와 동반되어 염증 유발 사이토카인이 증가되어 만성적인 낮은 등급의 염증(chronic low-grade inflammation)이 근육 감소증의 원인의 원인이 된다.
근세포의 감소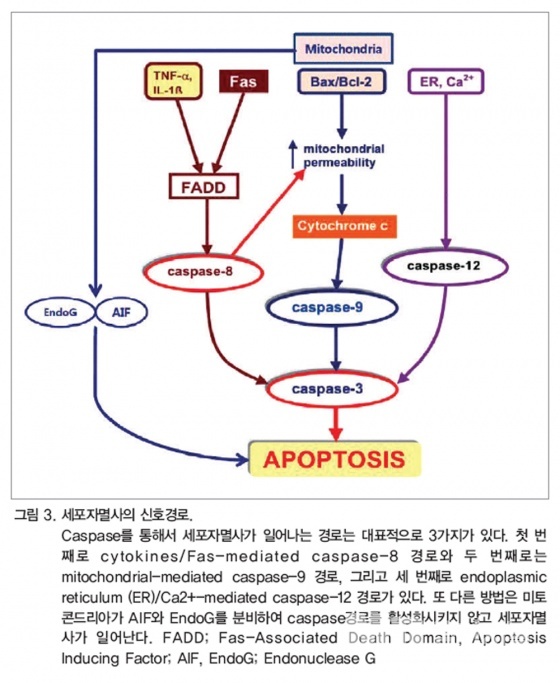 세포자멸사는 다세포 생물에서 성장 및 조직의 항상성을 유지하기 위해 중요한 생리적 과정이다. 하지만 노년에 근육세포의 세포자멸사가 가속화 되는 과정에 대한 분자생물학적인 기전은 아직 명확하게 밝혀져 있지 않다. 그러나 산화 스트레스와 만성 염증, 운동저하 및 인슐린 저항성 등이 주요한 원인으로 여겨지고 있다. 세포자멸사에 관여하는 요소는 크게 조절단백질(regulatory proteins)과 내부가수분해효소(endonucleases), 단백질분해효소억제제(protease inhibitors), caspase 등으로 알려진 단백질분해효소로 구성되어 있다. Caspase는 세포자멸사 과정에 가장 중요한 효소로 크게 내적 또는 외적인 경로에 의해서 활성화 된다. 외적 경로는 세포막에 있는 수용체( TNF-α 수용체, Fas 수용체)에 TNF-α 리간드가 결합하면서 촉발되며, 내적 경로는 미토콘드리아와 세포질세망(endoplasmic reticulum)이 연관되어 있다.
세포자멸사는 다세포 생물에서 성장 및 조직의 항상성을 유지하기 위해 중요한 생리적 과정이다. 하지만 노년에 근육세포의 세포자멸사가 가속화 되는 과정에 대한 분자생물학적인 기전은 아직 명확하게 밝혀져 있지 않다. 그러나 산화 스트레스와 만성 염증, 운동저하 및 인슐린 저항성 등이 주요한 원인으로 여겨지고 있다. 세포자멸사에 관여하는 요소는 크게 조절단백질(regulatory proteins)과 내부가수분해효소(endonucleases), 단백질분해효소억제제(protease inhibitors), caspase 등으로 알려진 단백질분해효소로 구성되어 있다. Caspase는 세포자멸사 과정에 가장 중요한 효소로 크게 내적 또는 외적인 경로에 의해서 활성화 된다. 외적 경로는 세포막에 있는 수용체( TNF-α 수용체, Fas 수용체)에 TNF-α 리간드가 결합하면서 촉발되며, 내적 경로는 미토콘드리아와 세포질세망(endoplasmic reticulum)이 연관되어 있다.
근육은 다핵 세포이기 때문에 세포자멸사의 과정이 매우 독특하여 세포가 사망하지 않은 상태에서 근육세포 핵들이 응축되고, 그 수가 감소하는 것을 특징으로 하는 ‘근육핵 세포자멸사(myonuclear apoptosis)’가 특징적으로 일어난다. 앞서 언급되었듯이 염증 유발 사이토카인과 호르몬 등이 외적 경로로 세포자멸사를 유도한다고 알려져 있지만, 이런 내적 경로 역시 노인에서의 근육 감소증과 매우 밀접한 연관이 있다. 동물 실험에서 늙은 설치류의 근섬유에서 세포자멸사의 대표적 분자인 Bax/Bcl-2의 비율이 어린 설치류에 비하여 증가하였고, 이러한 변화는 type II 근섬유에서 특히 두드러지게 나타났다. 또한 나이가 증가함에 따라 근육의 핵안에 있는 내부가수분해효소와 세포자멸사 유도인자(Apoptosis Inducing Factor, AIF)의 발현이 증가되었다고 하였다(그림 3. 참조).
이상과 같은 세포자멸사를 촉진시키는 근육세포내의 물질의 변화가 노화에 따른 근육 감소증의 중요한 요인이 될 수 있다.
<다음호에 계속>

