
생화학의 최신 경향을 소개하는 Trends In Biochemical Sciences지에서는 2015년 7월호의 주제를 “당질 코드의 마법”으로 정했다. 표지 배경으로 아름다운 그림이 하나 그려져 있는데, 이 그림은 독일 그림 형제의 동화 <은화가 된 별(The Star Tales)>에서 따온 것이다.
실루엣으로 비춰지는 소녀는 가난하지만 마음이 따뜻하다. 그녀가 가진 것이라고는 옷 한 벌과 빵 한 조각이 전부였는데, 그것조차 다른 이들에게 나누어준다. 이윽고 캄캄한 밤이 되어 하늘을 올려다 본 순간, 수많은 별들은 은화가 되어 떨어지고 소녀는 부자가 된다. 이 그림에서 인상 깊은 것은 하늘의 별들이 당사슬로 변하여 떨어지는 모습이다. 마치 마법과도 같다. 그런데 이런 마법 같은 일이 현실이 되고 있다. 그동안 원인을 규명하지 못했던 난치질환을 해결할 수 있는 열쇠가 바로 당과학에 있다는 것이 밝혀지고 있는 것이다. 이뿐만 아니라 많은 생명 현상의 비밀이 당질 코드에 의해 하나씩 풀려가고 있다. 2004년에 미국의 한 건강기능식품회사에서 개발한 식물 유래 다당체 식이보조제인 당영양소가 국내에 수입되면서 많은 의료 전문가들이 당생물학에 주목하기 시작하였다. 필자 역시 지난 십여 년 동안 당영양소의 가치와 효능에 대해 연구하며 임상에 적용해왔다. 특별히 이 지면에서 다루고 싶은 주제는 ‘특발성 혈소판 감소증(Immune 또는 Idiopathic Thrombocytopenic Purpura)’이다. 이 질환으로 인해 고통 받는 환자들에게는 희망의 메시지가 될 것이라는 마음으로 글을 썼다. 우선 당생물학의 기본적인 개요에 대해 설명을 해 보기로 한다.
세포막을 형성하는 당사슬이 없으면 세포는 사망한다
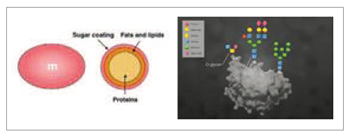
우리의 몸은 60조~100조개의 세포로 구성되어 있다. 각 세포의 표면은 당사슬로 빽빽하게 덮여있다. 이것은 마치 m&m 초콜릿과 비슷하게 생겼는데, 세포막의 가장 바깥층을 이루고 있는 것이 바로 당인 것이다. 자연계에 존재하는 200여 개 이상의 단당류 중에서 8가지가 모여 인체의 당사슬을 이룬다. 대부분이 당단백, 당지질, 단백다당체의 형태로 당복합체를 형성한다. 당단백은 2가지 종류가 있는데, 아스파라진 아미노산에 당사슬이 붙은 것을 N-glycan(N연결당사슬), 세린이나 트레오닌 아미노산 수산기에 당사슬이 붙은 것을 O-glycan(O연결당사슬)이라고 한다. 한 개의 세포에는 10만 개의 당사슬이 붙어있다. 그러나 현대인들의 당사슬은 대략 3~4만 개이며, 질병에 걸린 사람은 당사슬이 변형되거나 만 개 이하로 떨어져 있다. 수정에서부터 발생, 호르몬 활동, 면역기능, 뇌신경계의 활동 등에 당사슬이 관여한다. 당사슬이 결함되면 암, 대사질환, 유전질환, 뇌신경계 질환, 자가면역질환 등의 질병에 걸릴 수 있다. 또한 당사슬이 없으면 세포는 사망한다.
세포의 당사슬(glycan)에 어마어마하게 많은 정보가 담겨있다
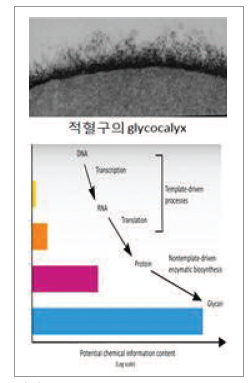
핵산, 단백질, 지질과 함께 당사슬은 생명체를 구성하는 기본적인 구성물 중 하나이다. 유전체학과 단백질체학에 비하여 당과학 분야는 상대적으로 연구가 덜 진행되고 있는 실정이다. 그런데 충격적이고도 놀라운 사실은 당사슬이 인체의 대부분의 질환과 아주 밀접한 관련을 갖는다는 것이다. 유전체 즉, 전통적으로 세포에 대한 정보는 유전체에서 시작하여, 단백질로 그 마지막 표현의 형태가 결정되는 것으로 알려져 있다. 그런데 단백질이 그 기능을 제대로 수행하기 위해서는 전사 후 수정(PTM, Post-Translational Modification)이 이루어져야 한다. 이 과정의 대표적인 것이 당화와 인산화이며, 인체 내 단백질의 70%는 당화된 당단백이다. 최종적으로 완성된 세포의 분자형태가 바로 당복합체인 것이다. 다음 그래프는 유전체에서 당복합체에 이르기까지 정보의 양을 보여준다. 세포에 붙어 있는 각각의 당 분자들은 정교한 조합에 의해 수천 개의 독특한 당사슬 구조로 합성된다. 선상구조인 DNA, RNA, 단백질과 달리 당사슬은 거대한 3차원적 구조를 가지므로 어마어마한 양의 정보를 담을 수 있다.
당사슬에 의해 세포의 정체성이 결정된다
당사슬(glycan)의 두꺼운 층을 글라이코캘릭스(glycoicalyx, 당사슬옷, 당의)라고 한다. 인체의 모든 세포가 글라이코캘릭스로 덮여 있기 때문에 당사슬은 질병의 발생과 아주 밀접한 관련이 있다. 당사슬은 인체에서 가장 기본적인 방어 역할을 하기 때문에 면역세포들이 가장 먼저 접촉하는 대상이 된다. 따라서 당사슬은 면역시스템에서 중요한 기능을 담당하는데, 그 역할은 바로 자기(self)냐 비자기(nonself)냐를 구별하는 것이다.
나이에 대한 정보가 당사슬에 담겨 있다
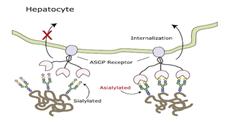
노화된 적혈구 또는 혈액 내 혈장단백질이 청소되는 과정을 살펴보자. 적혈구가 나이를 먹게 되면 그 표면에 있는 당사슬의 말단에 붙어있던 시알산(sialic acid, neuraminic aicd)이 떨어져 나가 갈락토즈가 노출된다. 간에 있는 아시알로당단백질 수용체(asialoglycoprotein receptor, ASGP-R)가 갈락토즈가 노출된 적혈구를 알아차리고, 이것들을 간세포 내로 이동시킨다. 이동된 적혈구들은 세포 내의 리소좀 안에서 분해되고 일생을 마치게 된다.
당사슬은 임파구의 이동을 지휘한다
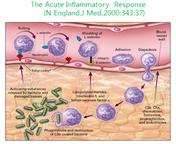
백혈구가 혈관 밖을 빠져 나가 조직으로 이동하는 과정을 살펴보자. 백혈구들은 내피세포 가까이로 내려오고, 그 표면을 따라 회전한다. 이때 백혈구의 회전을 유도하는 것이 바로 당단백질의 일종인 셀렉틴이다. 셀렉틴은 부착된 장소에 따라 그 당사슬의 구조가 달라진다. 각 조직마다 셀렉틴의 당사슬 형태가 달라지므로, 이를 통해 자가면역질환의 발생 부위를 확인할 수 있는 것이다. 임파구가 이동하는 데 있어서 서로 다르게 나타나는 당사슬의 구조를 이해한다면 각 조직에 맞는 방법으로 염증 치료제를 만들 수 있을 것이다.
대부분의 질환은 당화의 결함과 관련이 있다
당단백과 같은 당복합체의 변형이 많은 질환과 연관되어 있다. 당사슬의 정상적인 구조와 병적인 구조가 밝혀지면서 다양한 병의 기전이 규명되고 있는 것이다. 특히 당사슬은 자가면역질환 해결을 위한 중요한 열쇠가 될 수 있다. 각각의 자가면역질환마다 독특한 당사슬의 특성을 갖고 있기 때문이다. 그렇다면 다양한 자가면역질환 중 면역시스템과 관련된 부분을 살펴보자. 면역글로블린을 매개로 하는 자가면역질환의 발병 기전을 설명하겠다.
면역글로블린(항체)의 역할
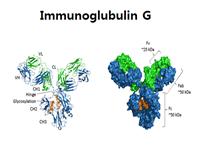
우선 면역글로블린의 구조를 살펴보자. (그림 6. 참조) 면역글로불린은 Fab와 Fc영역으로 나누어진다. Fab영역은 항원이 부착되는 부위이고, Fc영역은 면역조절기능을 담당한다. 여기서 Fc영역에서 가동되는 면역시스템 과정을 설명하고자 한다. 중성구나 대식세포와 같은 면역세포의 표면에는 Fc영역에 대한 수용체인 Fcγ수용체(FcγR)가 붙어 있다. 이 수용체에는 2가지 종류가 있는데 FcγRI, FcγRIIa, FcγRIIIa와 같은 활성 수용체와 FcγRIIb와 같은 억제 수용체로 구분된다. 항원이 들어오면 면역시스템이 가동되어 항원-항체 복합체가 형성되고, 병적인 세포를 죽이는 공격적인 경로가 만들어진다. 활성 Fcγ 수용체로 인해 탐식 작용, 항체 형성, 사이토카인 분비, 탈과립, 항체의존세포살상 등이 이루어지는 것이다. 그러다가 인체는 다시 균형을 찾게 된다. 활성 수용체로 인해 면역시스템이 가동된 다음에는 억제 수용체가 작동되어 항원-항체 염증 반응이 조절되는 것이다. 따라서 원활한 면역시스템을 위해서는 활성 수용체와 억제 수용체의 균형이 반드시 필요하다. 이와 같은 균형은 자가면역질환과도 관련이 깊다. 한 연구에 따르면, 억제 수용체인 FcγRIIb가 없는 쥐에서는, 활성화된 면역 시스템이 제어되지 않아 자가면역질환이 생길 수 있다는 것이 밝혀졌다. 따라서 Fcγ수용체의 활성과 억제 사이의 적절한 균형이 필요하며, 이를 통해 자가면역질환은 예방될 수 있다.
특정 자가면역질환은 면역글로블린의 당화의 변화와 관련이 있다
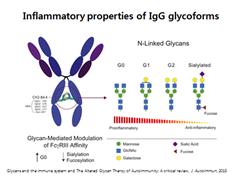
Fcγ수용체는 당단백으로 이루어져 있는데, 이것의 특성에 따라 면역반응이 활성화되거나 억제된다. 즉, 활성 수용체와 억제 수용체 중 어느 것이 가동되는가는 면역글로불린의 당사슬 구조에 따라 결정되는 것이다. IgG에 당화가 진행될수록 활성 수용체인 FcγRIII에 대한 친화력이 낮아지는 것으로 알려져 있다. 따라서 항원-항체 염증반응이 조절되어 항염증 상태가 된다. 반면, IgG의 당사슬에 결함이 있으면 FcγRIII에 대한 친화력이 높아져 면역반응이 가동되고, 염증반응이 일어난다.
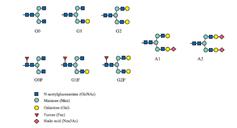
다음 그림을 보자. G0 당사슬은 갈락토즈가 결여되어 있고, 말단에 GlcNAc가 붙어있다. 당사슬이 결함된 G0 글리칸은 염증을 잘 유발하는 것으로 알려져 있다. G1과 G2 당사슬에는 갈락토즈가 1개 또는 2개가 붙어 있다. 완전히 당화가 된 당사슬은 시알산과 퓨코즈를 함유한다. 시알산이 함유된 당사슬은 FcrRIII에 대한 친화력을 감소시켜 항염증 기능을 갖는다.
앞서 당사슬의 결함이 자가면역질환과 관련이 있다고 설명했다. 당사슬의 비정상적인 구조가 보체 시스템을 활성화하여 자가면역질환을 유발하는 것이다. 또한 특정 자가면역질환마다 독특한 당사슬 구조를 갖고 있는데, RA, 유소년 관절염, 루푸스, 크론병 환자의 경우 면역글로불린에서 갈락토즈가 결여된 당사슬을 볼 수 있다. 여기에서 중요한 시사점을 발견할 수 있다. 당사슬에 시알산이 함유되면 항염증 기능이 향상되는데, IVIG(Intravenous Immunoglobulin) 치료가 이와 같은 사실을 반영한다는 것이다. 지난 30년 전부터 IVIG의 항염증 효과는 잘 알려져 왔다. 건강한 인체의 IVIG에는 시알산이 풍부하기 때문이다. IVIG가 탈시알산화되면 항염증 기능을 상실하는데, 이를 통해 IVIG의 항염증 기능은 시알산이 부착된 IgG-Fc의 조합과 관련이 있다는 것을 알 수 있다.
ITP에 대한 설명
특발성 혈소판 감소증은 자가항체에 의하여 혈소판이 파괴되는 출혈 질환이다. 인구 십만 명당 9.5명이 발생한다는 보고가 있다. 혈소판 수가 감소하면서 출혈이 되고, 환자의 5%에서는 심한 뇌내 출혈이 나타난다. ITP 환자는 치명적인 출혈 경향을 가지고 살아가며, 계속적인 치료를 통해 혈소판 수를 관리해야 한다. 이 때문에 삶의 질은 현격하게 떨어질 수밖에 없다. 일차 치료에서는 면역억제제와 면역조절제(코티코스테로이드, IVIG, anti-RhD)를 사용한다. 이 치료에 반응이 없는 환자의 경우, 비장 절제도 고려한다. 환자의 15~25%는 이유를 알 수 없이 일차 치료와 비장 절제 치료에 반응하지 않는다. 오늘날 임상 현장에는 ITP 치료의 성공 여부를 예측할 만한 측정 방법이 없는 실정이다. ITP는 1차적으로 혈소판 표면에 있는 당단백질(GPIIaIIIa &/or GPIb 복합체)에 대한 자가 항체로 유발되는 질환이다. 여기에서 혈소판의 분자생물학적인 구조에 대하여 알아보기로 한다.
혈소판의 형태 및 구조
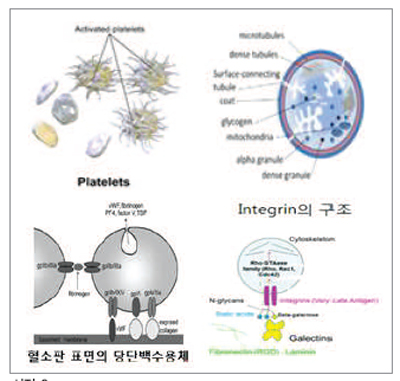
염색된 혈소판을 현미경으로 관찰하면 자줏빛의 미세한 과립 형태를 띤다. 혈소판의 크기는 약 2~3㎛이며, 적혈구의 5분의 1 정도로 매우 작다. 말초 혈액 내에서 혈소판은 적혈구 10~30개당 1개 정도로 관찰된다. 혈소판의 외피는 당사슬로 덮여 있는 당단백인데, 혈소판의 부착과 응집을 주도하는 역할을 담당한다. 내부에는 혈소판의 기능에 관여하는 여러가지 물질과 각종 응고인자들이 함유된 과립이 들어 있다. 면역반응에서 항원 역할을 하는 것이 바로 혈소판의 표면에 있는 당단백질(glycoprotein, GP)로 이루어진 수용체들이다. 가장 주도적인 역할을 하는 것은 GPIIbIIIa와 GPIb 두 가지인데, 이들은 구조적으로나 기능적으로 서로 다른 특징을 갖는다.
ITP의 Fc경로 의존치료
ITP는 1차적으로 혈소판 표면의 당단백질 수용체인 GPIIbIIIa와 GPIb복합체에 대한 자가항체로 유발되는 아주 흔한 출혈질환이다. 이들 수용체의 N-연결 당사슬과 O-연결 당사슬의 말단에는 시알산이 부착되어 있다. ITP 환자의 70~80%는 GPIIaIIIb(integrin aIIbB3)에 대한 항체를 갖으며, 20~40%는 GPIb복합체에 대한 자가항체를 갖고 있다. 현재까지의 이론은 Fc-FcrR과의 상호작용으로, 혈소판이 비장에서 대식세포에 의해 제거된다고 보고 있다. 혈소판 표면에 부착한 자가항체의 Fc 부위와 세망내피계의 조직에 있는 대식세포의 FcγRIIa와 FcγRIIIa가 서로 결합하면서 대식세포는 혈소판을 탐식하게 되며, 이를 통해 비장에서 혈소판이 파괴된다는 것이다. 이러한 Fc-Fcr경로 기전을 바탕으로 하여, 1차 치료에서는 IVIG(면역글로불린G), anti-RhD로 혈소판 수를 회복시킨다. 이 치료의 기전은 자가항체가 활성 Fcγ수용체인 FcγRIIa 또는 FcγRII와 결합하는 것을 차단하는 것이다.
ITP의 Fc경로 비의존치료
그런데 위와 같은 Fc경로에 의존하지 않는 새로운 기전이 밝혀졌다. 한 연구에 따르면, 대식세포의 FcγR(-)인 쥐에서 F(ab)II(Fc비의존성)를 통하여 혈소판 GPIbα에 대한 항체가 형성되고 이로 인해 혈소판 감소증이 유발되었다. 사람의 anti-GPIbα 매개 ITP에서, Fc경로를 타겟으로 하는 코티코스테로이드나, IVIG, anti-RhA, 비장 절제와 같은 1차적 치료에 반응이 없는 경우가 있다. 여기에서 혈소판 감소증의 새로운 기전인 Fc 비의존 경로를 밝히고, 이에 대한 진단과 치료적 가능성을 제시하고자 한다. GPIbα는 혈소판 표면에서 2번째로 가장 풍부한 수용체로, 세포외 기질 리간드가 부착되는 자리이다. 이것에 von Willebrand factor가 부착되면서 GPIbα outside-in signaling이 시작된다. 이후 GPIIbIIIa가 활성화되고, 혈소판의 응집이 유도된다. GPIbα는 혈소판 표면 단백질 중 가장 많이 당화된 당단백으로서, 탄수화물의 무게가 60%를 차지한다. GPIbα는 N-linked 당사슬과 O-linked 당사슬 두 가지를 모두 포함하며, 말단에는 시알산이 붙어있다. 이 시알산의 양은 혈소판의 총 시알산 함유량 중 64%를 차지한다. 어떤 이유에서든 GPIbα에 대한 anti-GPIbα는 혈소판의 활성화와 GPIbα의 탈시알산화를 유도한다. 또한 GPIbα의 탈시알산화는 다시 혈소판의 활성화를 유도한다는 가능성이 제기된다. 이것은 혈소판 활성화와 GPIbα 탈시알산화 사이에서, 양성피드백 순환 고리가 생성될 수 있음을 암시한다. 탈시알산화된 GPIbα는 간세포의 아시알로당단백수용체(asialoglycoprotein receptor, Ashwell-Morell Receptor, AMR)에 의해 인식되어 제거된다. 이런 과정을 통해 AMR은 정상적인 혈소판의 턴오버를 유지하는 역할을 하고, 항체 매개로 인해 탈시알산화된 혈소판을 파괴하는 역할을 하는 것으로 본다. 이 같은 사실은 시알리다제(sialidase)의 억제가 ITP의 경향을 약화시킬 수 있다는 것을 보여준다. anti-GPIbα 양성인 ITP 환자는 표준화된 1차 치료에 잘 반응하지 않는 경향이 있다.
위의 내용과 관련된 연구 결과를 살펴보자. anti-GPIbα가 주사된 쥐에서 시알리다제 억제제를 투여했을 때 혈소판의 탈시알산화 정도가 감소되었고 혈소판 수가 유지되었다. 또한 anti-GPIbα 매개 ITP환자의 경우, 항인플루엔자로서 neuraminidase(sialidase)를 저해하는 타미플루를 사용했을 때 혈소판 수가 유지되었다. 이것은 시알리다제 저해제가 ITP의 또 다른 치료제로 사용될 수 있다는 것을 뒷받침하는 증거가 된다. 정리를 해 보면, anti-GPIbα 매개 ITP는 Fc 비의존 기전으로, 발병 기전과 치료에 있어서 기존의 Fc의존과는 차이가 있다. GPIbα에 대한 항체가 혈소판의 탈시알산화를 유도하고, 당사슬이 결함된 혈소판은 간에서 포착되어 제거된다. 대식세포가 아닌 간세포에 의해 혈소판의 탐식작용이 이루어지는 것이다. 중요한 것은 시알리다제 저해제가 이런 병적인 과정을 차단하고, 혈소판의 감소를 완화시킬 수 있다는 것이다. 이러한 소견은 ITP의 새로운 발병기전뿐만 아니라 새로운 진단도구와 치료방법도 제시해준다. 이 같은 사실은 기존의 1차적 치료에 반응하지 않는 ITP 환자들에게 중요한 의미가 될 것이다. 이 대목에서 타미플루의 당생물학적 원리를 짚어보고자 한다. 우선 독감 바이러스가 인체 내에서 감염되는 과정을 살펴보자. 바이러스의 표면에는 당단백질인 헤마글루티닌(HA)과 뉴라미니다아제(NA)가 존재한다. 바이러스가 세포 안으로 들어올 때, 헤마글루티닌이 세포의 당사슬 말단에 붙어있는 시알산과 결합한다. 이후 바이러스가 증식한 뒤, 세포 밖으로 빠져 나갈 때에는 시알산을 잘라주는 효소인 뉴라미니다아제(시알리다제)가 작동된다. 이렇게 시알산이 제거되면 독감 바이러스는 세포 밖으로 방출되어 또 다른 세포로 감염되는 것이다. 이 과정에서 시알산이 제거되는 것을 차단하는 시알리다제 저해제가 바로 타미플루인 것이다.
당영양소의 임상적 가치와 활용
우리는 혈소판의 탈시알산화(desialylation)에 의한 ITP를 치료하기 위한 보완요법으로 당영양소에 주목할 필요가 있다. 2011년 European Journal of Clinical Nutrition지에 발표된 논문인 ‘식물유래 다당체인 식이보조제가 건강한 사람의 혈청 당단백의 당화에 미치는 안정성과 효과에 대한 연구’를 보자.
건강한 개인에게 식물유래 다당체 복합물을 경구 투여한 뒤, 혈장 내 N-연결 당사슬의 상태를 분석했다. (그림 11. 참조) 연구 결과, 식이보조제의 용량을 늘릴수록 G1, G2와 같은 중성의 당사슬 수준은 내려간 반면, 완전히 당화가 진행되어 시알산이 부착된 A2의 수준은 현저하게 증가했다. 또한 고용량에서도 피실험자들 모두에게서 부작용은 나타나지 않았다.
시알산의 증가가 면역학적 성질에 영향을 미친다는 사실은 이미 알려져 있다. 시알산화가 되었을 때 항염증 기능이 증가하며, 그 반대의 경우 염증이 잘 유발된다. 결론적으로, 이 식이 보조제가 혈장 단백질의 당화와 면역 반응에 긍정적인 영향을 미친다고 할 수 있다. 이와 같은 사실은 ITP에 대한 기존의 1차 치료와 이에 반응하지 않는 경로에 대한 치료 모두와 관련이 깊다. 1차 치료에는 시알산이 풍부한 IVIG에 항염증 기능이 있다는 사실이 반영되었기 때문이다. 마찬가지로 1차 치료에 반응하지 않는 Fc비의존 경로에서도, 혈소판의 시알산화를 유도하여 항염증 효과를 기대한다. ITP에 대한 기존의 1차 치료와 시알리다제 저해제의 치료 원리를 살펴보았다. 여기에 더해 우리는 새로운 가능성에 기대를 걸어볼 수 있다. 바로 시알산을 직접적으로 증가시킬 수 있는 식물유래 다당체인 당영양소의 효과에 주목하는 것이다. 앞으로도 당영양소와 면역의 관계에 대한 연구는 더 필요할 것이다. 이를 통해 기존의 질병에 대한 다양한 발병 기전이 규명될 것이다. 연구 결과에 입각하여 치료제 개발에 힘쓰는 것은 물론, 보완요법으로서 당영양소의 역할을 제시할 수 있을 것이다. 당영양소는 질병을 예방하고 인체의 건강을 증진하는 데 필요한 마법과도 같은 열쇠가 될 것이라 믿는다.

