필자는 여러 해 전부터 통합의학1.0과 통합의학2.0의 차이점, 개인별맞춤의학(personalized medicine)이 통합기능의학이 지향점이라는 걸 자주 이야기하였고 현재도 변함은 없다. 그런데 2015년 미국 오바마 대통령이 정밀의학에 대해 미래의학의 방향으로 선언하면서(THE PRECISION MEDICINE INITIATIVE: 이하 PMI) 유전체의학이 의학의 중심으로 떠오르고 있다.
여기서 하나 짚고 넘어가야 할 것은 personalized medicine과 precision medicine의 뜻은 유사해 보인다. 하지만 왜 용어의 차이에 의사들이 관심을 가져야 우리가 가야 할 방향을 이해하고, 어떻게 행동해야 할 것인지 의료인 여러분들이 판단할 수 있을 것 이다.

21세기 의학은 진실 되고 개별화된 치료 방향으로 전진하고 있다. 주류의학에서 기존 의학자들은 personalized medicine으로 명명하였다. 그런데 precision medicine이라고 명명한 배경에는 정밀의학 추진 코호트 프로그램 책임자인 에릭 디쉬맨(Eric Dishman)의 경력을 보면 가늠해 볼 수 있다. 추후 의학의 주도권을 누가 선도할 지 알 수 있을 것이다. 디쉬맨은 정밀의학의 기초연구가 많이 행해진 의학 분야가 아닌 실리콘밸리에서 왔다. 인텔의 건강 전략과 해법 그룹의 전 책임자로서 건강관리에 깊이 있는 경험이 있었다. 그는 인텔 건강관리연구를 책임지는 팀 및 제품 혁신, 기준 세팅 활동을 하였다. 그는 또한 정밀의학이니셔티브(PMI) 그룹의 핵심멤버로도 활동하고 있다. 디쉬맨은 25년간 첨단기술에 몸담아왔다. 그는 졸업하고 바로 폴 앨런의 두뇌집단[마이크로소프트 공동 창업자]에서 처음 일하고 인텔에서 지난 17년간 일해 왔다.
순수한 의료인이 아니라 공학자가 제안한 용어로 정밀의학이 선택되었고, 분명한 것은 미래의학이 21세기에 실리콘밸리의 큰 먹거리가 될 것이고, IT전문가들이 BT을 융합하면서 뭔가 새로운 주도권을 잡기 위해 PMI를 정치와 손잡고 간다는 의미이다. 개인별 맞춤의학(Personalized medicine)이라는 용어는 인간적인 의미가 포함된 특정한 개인을 위하는 측면이 강조된다고 해서 서서히 퇴조하고 있는 것 같다.
이제 의사들이 생각하는 고전적인 진료방식에서 벗어나지 않으면 도태될 수 있다는 의미이다. 최근 김영사에서 한글판으로 출간된 “호모 데우스: 미래의 역사”에서 유발 하라리 저자가 “데이터를 숭배한 인간, 신을 넘보다”고 말하는데 유전체 의학은 이미 Big Data를 다루다 보니 주도권이 수학, 공학자들에게 넘어가는 듯한 느낌이 드는 것, 필자 역시 피 할 수 없다. 정밀의학 데이터처리는 기상학, 천문학, 물리학보다 큰 가장 방대한 문제다. 원래 기상학, 천문학, 물리학 이런 분야들은 가장 대량고속처리가 필요한 전통적인 분야였다. 이제 10여년 후에는 환자 1인당 평균 데이터 생성량이 50Tbytes로 추정하고 있다. 참고로 심평원에 1년에 전국 병·의원에서 의료보험 청구용 데이터가 2Tbytes정도이다.
이번 호에는 유전체 현황에 대한 간략한 소개, 다음 호에는 통합기능의학에서 중요하게 다루는 영양유전체에 대해서 자세히 다루고자 한다.
1. 최근 유전체분석 기술소개와 비용
2. DTC 서비스의 확대
3. 국내 NGS기반 유전체 분석 보험적용
4. 암유전체응용
5. 약물유전체응용
6. 산전진찰NIPT 응용
7. 후성 유전학의 응용
8. 영양유전체의 중요성
9. Microbiome의 응용
10. EBM에서 Data-driven medicine(데이터기반의학)으로 이동
11. 교육의 필요성과 교육기관소개
1. 최근 유전체 분석 기술소개와 비용
2003년 휴먼게놈프로젝트가 완성된 이후에 유전체 의학과 관련된 기술은 비약적으로 발전하였다. 휴먼게놈프로젝트는 1990년부터 15년을 계획으로 시작되었다. 총 30억달러가 들어가고 미국, 영국, 일본, 독일, 프랑스, 중국의 6개 나라와 셀레라제노믹스라는 민간회사가 참여한 대규모 프로젝트였다. 프로젝트의 진행과 함께 분석 기술도 발전하였기 때문에 예상 계획보다 2년 빠른 2003년에 마무리되었다. 이 휴먼게놈프로젝트 이후에 많은 후속 연구들이 시작되었고, 이로 인한 경쟁과 발전은 유전체 분석 비용을 획기적으로 감소시켰다.
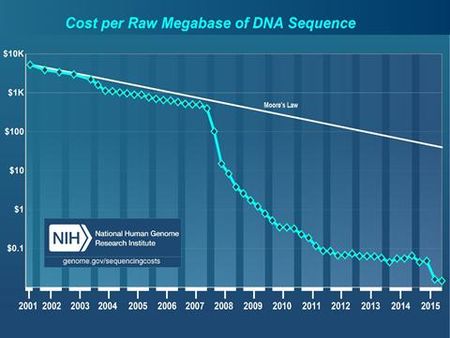
무어의 법칙은 반도체의 집적회로의 성능이 18개월마다 2배로 증가한다는 현상을 설명한다. 유전체 기술 발달의 추이를 이 법칙에 대입해 보면 유전체 서열 분석 비용이 얼마나 빨리 낮아질 수 있는지 예측할 수 있다. 이런 분석비용의 절감은 서열분석기를 제작하는 회사들이 기존과는 다른 분석법을 개발 응용하면서 가능해졌다.
전 세계 서열분석기 시장의 상당부분을 점유하고 있는 illumina사는 대상 유전체를 100~150개정도로 잘라 분석을 하고, 그것을 컴퓨터의 알고리즘을 이용해 이어붙이는 방식을 취하고 있다. 2014년에 출시한 HiSeq X Ten장비는 유전체 분석을 위한 전처리 작업을 포함해 인간 전장유전체 분석 비용을 1,000달러까지 낮추었다. 2017년 발표한 NovaSeq장비는 분석가능 시간과 능력을 또 한번 업그레이드하였다. 이 회사 대표도 5년 내에 인간 전장유전체 분석 비용을 100달러까지 낮출 것이라고 말하고 있다. 이런 방식들은 효율적이긴 하지만 유전체 안에 반복서열이 길게 자리 잡고 있는 부위는 분석하기 어려운 단점도 있다. Oxford Nanopore사의 MinION 서열분석기는 최장 분석 가능한 서열 길이가 950,000개의 염기까지 가능하다고 알려져 있다.
이 분석기는 크기도 한손에 쥘 수 있을 만큼 소형화 되어 있다. 나아가 동일 회사에서 개발하고 있는 SmidgION은 스마트 폰에 연결해서 사용 가능하도록 만들 계획이라고 밝히고 있다.
이제는 저렴한 비용에 언제 어디서나 본인의 유전체 서열을 알 수 있는 시대로 진입하고 있다. 유전정보에 대한 이런 획기적인 접근적 향상은 의료의 앞날에 상당한 변수로 작용할 것이다. 감기에 걸렸을 경우 집에 있는 서열 분석기에 침 한 방울만 뱉으면 자동으로 서열 분석이 되고, 그 서열을 인터넷에 있는 바이러스 유전체 데이터베이스와 대조해 보면 어떤 바이러스에 감염되었는지 바로 알 수 있으리라는 예측이 더 이상 허무맹랑한 상상이 아닌 것이다. 이러한 의학 기술의 발전이 기능의학을 하는 의사들에게는 어떤 도움을 줄 수 있을지 알아보고 미리 준비하는 시간을 갖는 것이 필요하다.
2. DTC 서비스의 확대
2006년미국의23andMe는 소비자를 대상으로 한 직접검사(DTC, Direct-To-Consumer) 판매를 시작했다. 이 상품은 처음에는 질병 위험도 예측 서비스를 제공했지만 정확성과 안정성 문제로 2013년에 FDA로부터 판매중단 처분이 내려졌다. 그 이후에는 의료서비스에 들어가지 않는 조상 계통 분석 정보만 제공하다가, 2017년 4월 6일 FDA로부터 질병 위험도 예측 서비스 판매를 허가 받았다. 이제는 파킨슨병, 알츠하이머병, 낭성섬유증을 포함한 총 10가지 질병에 대해 질병위험도를 분석해서 제공할 수 있게 되었다.
국내에서도 2016년 6월 30일부터 제한적으로 DTC 유전자 검사 서비스가 허용되어 의료기관을 거치지 않고 소비자가 직접 유전자 검사를 의뢰할 수 있게 되었다. 물론 검사항목이 제한되어 있고 질병 위험도 예측 같은 의료적인 부분은 금지되어 있다. 하지만 지금도 23andMe같은 업체에 배송대행을 통해 검사를 의뢰하고 그 유전체 정보를 이용해 조상 찾기 같은 활동을 하는 사람들은 늘고 있다. 23andMe에 분석을 의뢰한 일반 소비자가 이제 200만명을 넘어섰다. 국내 업체들이 오히려 외국 업체에 비해 역차별을 받는다는 요구들이 있기 때문에 국내업체에 이 검사들이 네거티브 방식으로 폭넓게 허용되고, 서비스에 대한 일반소비자들의 인지도가 높아지면 국내에서도 본인의 유전체 정보를 들고서 진료를 받으러 오는 환자들이 늘어날 수 있을 것이다.
3. 국내 NGS기반 유전체 분석 보험적용
2017년3월부터 차세대 염기서열분석(NGS, Next-Generation Sequencing) 기반 유전자 패널 검사에 건강보험이 적용되고 있다. 기존에는 유전자를 개별적으로 검사했기 때문에 한 유전자 당 검사비가 15~ 87만원 선으로 고가였다. 그런데 NGS 기술을 이용한 유전자 패널을 사용할 경우 한 번에 수 십개에서 수 백개의 유전자를 패널 하나에 집적해 분석하기 때문에 85~120만원 정도로 검사 비용을 현저하게 줄일 수 있다. 이렇게 획득한 유전자 변이 정보는 항암 표적치료제 개발 같은 중증 질환 뿐 아니라 건강 증진과 예방 관리 차원에서 파이토케미칼들의 처방의 강력한 근거 기반이 될 수 있을 것이다.
· 문제점 지적 : 2017년 5월 현재 국내에서 일부 유전자검사에 대한 보험적용을 NGS장비를 설치한 의료기관에만 국한한다는 넌센스 같은 제도를 시행한다고 발표했는데 누구의 아이디어인지 의심스럽다. 의학의 발전에 일부 패권주의, 신비주의를 조장하는 학계나 정부기관 모두가 반성해야 한다.
4. 암 유전체 응용
일반적으로 암의 발생은 여러 다른 유전자의 돌연변이를 필요로 한다. 정상적인 세포가 적절한 위치, 적절한 시기에 분열과 증식을 하기 위해서는 여러 기전의 절묘한 상호작용을 요구한다. 인체는 또한 비정상적인 세포가 암이 되기 전에 제거할 수 있는 방어기전을 가지고 있다. 대부분의 암에서 돌연변이는 평생에 걸쳐 누적된 결과로 여겨지고 있다. 이 누적된 돌연변이가 비정상적인 세포를 제거하는 보상기전을 무력화하고, 통제되지 않는 종양으로 자랄 때까지는 문제를 일으키지 않는다. 종양이 계속 자라기 시작하고, 세포가 빠르게 분열하면서, 종양이 더 공격적이고 전이가 쉽게 일어날 수 있는 추가적인 돌연변이가 일어날 수 있다. 암 발생에 영향을 미치는 돌연변이 유형에는 많은 것들이 있다. DNA 돌연변이를 태어날 때부터 가지고 있을 수도 있고, 살면서 자발적으로 생길 수도 있다. 부모로부터 물려받은 돌연변이는 생식세포 돌연변이(germline mutation)라고 하고 보통 우리 몸의 모든 세포에 가지고 있다. 생식세포라는 말은 돌연변이의 기원이 정자 또는 난자이기 때문에 붙여진 말이다.
생식세포 돌연변이는 그것을 가지고 있는 가계에 가족성 암의 발병을 유발하는 원인이 된다. 살아가며 발생하는 돌연변이는 체세포 돌연변이(somatic mutation)라고 부른다. 피부 세포 안의 DNA가 태양 빛의 자외선에 노출되어 손상 받는 것처럼 DNA가 직접적으로 손상을 받거나, 세포가 분열하는 동안 DNA의 복제에 오류가 발생되어 생길 수 있다. 체세포 돌연변이는 부모에서 자식으로 물려지지는 않는다. 생식세포와 체세포 돌연변이는 단일 염기 변화, 삽입/결실과 큰 구조적 변이를 포함한다. 많은 암에서 나타나는 돌연변이중의 하나가 유전자 융합(gene fusion)이다. 유전자 융합은 전형적으로 염색체 재배열로 나타나는데, 유전자 또는 그 조절유전자 서열부위가 합쳐지면서 전암유전자(proto-ncogene)가 될 수 있다.
이런 경우 전암유전자가 비정상적으로 활성화된 단백질을 발현하면서, 세포는 통제 불능으로 증식하게 된다. 암과 연관된 융합 유전자중에 많이 알려져 있는 것이 BCR-ABL 융합이다. 이것은 만성골수성백혈병(CML)의 특징으로 95%이상의 환자에서 발견되고 있다. BCR-ABL 융합유전자는 항상 켜져 있어 지속적으로 활성화된 단백질을 만들고, 이것이 통제되지 않는 세포의 증식을 가져와 암으로 발전한다.

최초의 허가 받은 표적항암제인 글리벡(imatinib)은 BCR-ABL이 만든 막단백질의 tyrosine kinase 근처에 붙어서, 이 단백질을 억제해서 효과를 나타내게 된다. 이 글리벡은 만성골수성백혈병을 만성질환으로 여길 수 있도록 만들었다. 이런 성공에 힘입어 그 이후에 수많은 표적치료제가 개발되고 있다.
BRCA1과 BRCA2는 영화배우 안젤리나 졸리가 양성으로 판정받아 예방적 유방절제술을 받으면서 유명세를 타게 되었다. BRCA1과 BRCA2는 암억제유전자(tumor suppressor gene)로 유방암 및 난소암과의 관련성이 알려져 있다. 이 유전자가 만드는 단백질은 손상된 DNA를 복구해서 유전체의 안정성을 유지하는 역할을 한다. 70세까지 유방암이나 난소암을 진단받은 여성 중에 BRCA1이나 BRCA2의 생식세포 돌연변이를 가지고 있는 비율이 80%를 넘는다.
하지만 이 유전자의 돌연변이는 가족성 유방암 원인의 15-20% 정도만 설명가능하다. 다른 유전자의 변이가 10%정도를 차지해서, 아직 70% 정도는 원인이 밝혀져 있지 않은 상태다. 또한 주의 깊게 생각해야 할 것은 2003년 Science지에 출판된 킹박사의 논문에 의하면 이 BRCA 유전자 변이가 있는 사람이라도 1940년 이전에 태어난 사람은 50세까지 유방암에 걸릴 위험이 24%인 반면에, 1940년 이후에 때어난 사람은 64%였다고 한다. 이는 유전자 변이가 있다 하더라도 환경과 생활습관이 중요한 변수가 될 수 있음을 시사한다. BRCA 1 or BRCA 2유전자에 변이가 있고 가족력, 환경 여러 요인을 참고하여 안젤리나 졸리가 했던 유방·난소 절제술을 예방적 목적으로 시행하였다. 그러나 통합기능의학적으로는 어떤 경우에 예방적 수술을 피하고 관리할 수 있는 방법이 있다. 마찬가지로 유전자 검사를 하여 BRCA유전자 뿐 아니라 다음과 같은 다른 유전자의 변이를 참고하여 주기적으로 관찰하고 약물이 아닌 생활관, 식이요법, 그 사람에게 가장 적절한 건강기능식품 등을 nutrigenomics을 이용 추천하여 줄 수 있을 것이다.
유전체를 이용한 조기 진단과 치료 효과 경과 관찰이 주목을 받고 있다. 암치료의 성적은 진단시기가 큰 영향을 미친다. 최근 연구에 따르면 고형암 세포의 DNA가 혈액 속에서 발견될 수 있음이 알려졌다. 암 세포가 사멸할 때 그 내용물이 혈액으로 유입되는 것으로 생각되고 있다. 이런 순환암DNA(ctDNA, circulating tumor DNA)는 간단한 혈액 검사만으로도 추적 가능하기 때문에 조기암 진단에 유용하다. 비소세포폐암에서 빈번한 체세포 돌연변이를 보이는 139개 유전자를 검사했을 때, 1기 비소세포폐암 환자의 50%에서 ctDNA가 검출되었고, 2기에서 4기 환자는 모두 검출되었다. 또 다른 연구에서는 암 절제술 후에ctDNA가 존재하면 암 재발률이 증가되는 것을 보여주었다.
5. 약물 유전체 응용
유전자는 약물의 대사, 부작용과 약물 상호작용에 영향을 미친다. 잘못된 약물 용량이나 위험한 부작용은 생명을 위협하는 결과를 가져올 수 있기 때문에 이 정보는 상당한 무게를 갖는다. 이 분야에서 연구된 많은 유전자가 사이토크롬 P450s(CYP, cytochrome P450s)같은 단백질인데, 이것은 자연 화합물로 호르몬을 만들거나 독소를 제거할 때 관여한다. 우리 인간의 유전체에는 사이토크롬P450s을 암호화하는 유전자가 80여개 존재한다.
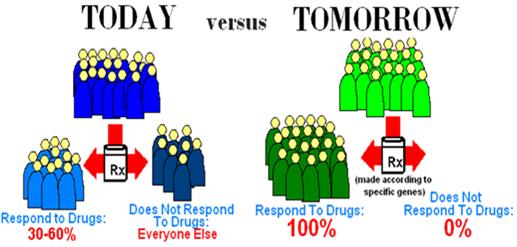
다음 그림과 같이 현재 약물 처방 성공율이 30-60% 정도 앞으로는 약물유전체학을 적용하여 약물 처방 성공율을 100%,부작용을 최소화하려고 시도하고 있다.
약물 용량에 미치는 유전자의 영향이 잘 밝혀진 물질이 와파린이다. 와파린은 대표적인 항응고 약물로 치료범위가 좁아 용량이 조금만 올라가도 출혈을 일으킬 수 있고, 부족하면 효과가 없는 투여용량 결정이 까다로운 약물이다. 와파린의 대사는 VKORC1과 CYP2C9, 두 유전자의 영향을 받는다. VKORC1 유전자의 조절유전자 부위에 1639 번 G 염기가 A 염기로 바뀐 단일 염기 변이가 단백질 생산을 감소시키기 때문에, 환자 혈액의 응고를 방지하기 위해 더 적은 와파린이 필요하다.
CYP2C9의 경우에는 CYP2C9*3(I359L)과 CYP2C9* 2(R144C)의 두 변이형태가 존재하는데, 이것은 약물의 대사를 느리게 만든다. 따라서 이 변이가 있는 사람은 약물 용량을 줄일 필요가 있다. 또 다른 예로는 타목시펜을 들 수가 있다. 타목시펜은 에스트로겐 수용체 양성인 유방암의 치료에 사용하는 항암치료제다. 이 약물은 사이토크롬 2D6에서 대사되어 활성화된다. CYP2D6*4/*4 변이는 활성이 떨어지는 단백질을 만들기 때문에 타목시펜을 활성화시키지 못해 변이가 없는 wild type CYP2D6 유전자를 가지고 있는 환자에 비해 무병생존기간이 짧다는 보고도 있다.
<< 남성과 여성의 약물에 대한 다른 반응의 예 >>
| 약물 | 성 차이 |
| 스타틴 | 여성에서 근육병증이 더 잘 생기는 경향이 있다 |
| 베라파밀 | 여성에서 혈압강하가 더 크다 |
| 암로디핀 | 여성에서 혈압강하가 더 크다 |
| 아스피린 | 여성에서 뇌졸중 위험 감소는 더 크지만 심근경색의 위험감소는 더 적다 |
유방암환자에서 타목시펜에 부작용이 심할 때 단순히 타목시펜에 반응하지 않은 경우는 2017년 MD저널 2,3,4월호에 “유방암과 관련한 에스트로겐 지수 변천사”를 참고하면 유방암환자 진료에 많은 도움이 될 것이다.
위 도표에서 보면 이제는 단순히 에스트로겐, 프로게스테론, 테스토스테론 뿐 아니라 에스트로겐 대사산물과 유전체 관계를 이해하면서 검사결과도 보여 주고 있고 실제 임상에서 필요하다면 유전체 검사와 병행해서 이용하면 많은 도움이 된다. 통풍 환자의 높아진 요산 수치를 떨어뜨리기 위해 많이 사용하는 allopurinol은 심각한 피부 부작용인 약물 유발 과민반응, 스티븐존슨 증후군, 독성표피박리증등을 유발하는 것으로 알려져 있다.
그런데 이런 부작용이 HLA-B*5801 대립유전자를 가지고 있는 환자에서 많이 발생하는 것이 밝혀졌다. 이 유전자는 한국인의 경우 12.2%에서 가지고 있고, allopurinol 유발 SCAR(Severe Cutaneous Adverse Reaction)를 경험한 환자의 92%가 가지고 있는 것으로 조사되었다. 이 변이 유전자를 가지고 있는 환자는 allopurinol 투여시 탈감작 요법을 권고하고 있다.
남성과 여성은 다른 약물 대사 효소를 다른 수준으로 발현하고 있다. 즉, 많은 사이토크롬 P450이 남성과 여성의 간이나 신장에 다르게 발현된다. 또한 체격의 차이도 있다.
현재 Genomind라는 회사는 정신과 질환, 약물에 반응하지 않는 우울증(treatment resistant depression)에 적정 약 종류, 약물 부작용 최소화 그리고 대안으로 개인에 맞춘 영양소 등을 추천해 주고 있다.

특히, 필자의 경험으로는 정신과 환자에서 장기간 약물 복용으로 대사증후군, tardive dyskinesia 등의 부작용이 있을 때 유전체검사에 근거를 둔 Genomind가 많은 도움이 되었다. 약물 감량, 영양소 선택 시 검사회사에서 상담도 해주고 실제 무작위로 시도 하는 것보다는 근거를 가지고 환자나 보호자를 설득하면 잘 따르기 때문에 결과도 좋다.
<다음호에 계속>

