[엠디저널]미래 의료의 조율자로 후성유전체에 대한 관심이 고조되면서, 통합기능의학에서는 약물 유전체 보다는 생활습관과 식이 개선을 필두로 하는 영양 유전체학을 구심점으로 연구와 임상을 진행하고 있다. 그 수많은 포커스 중 장래성 있는 결과를 쌓아가고 있는 메틸화 대사 유전체 연구가 임상적으로 큰 주목을 받고 있으며, 이에 덩달아 methylation doctor, methyl gueen이라며 자화자찬으로 나서는 임상가들도 늘어나고 있다.
필자 역시 메틸화 대사의 중요성을 여러 차례 언급해 왔으며, 그렇다면 이렇게 결정적인 메틸화 대사를 가늠할 수 있는 생체 지표는 과연 무엇인가 궁금증이 생길 차례다.
Carl Pfeiffer(1908-1988)박사는 메틸화 정도와 히스타민 대사의 인과 관계를 주장하며 저메틸화(UnderMethylation)-히스타민 상승(histadelia), 과메틸화(OverMethylation)-히스타민 부족(histapenia)으로 정신질환들을 풀어나갔다. 그 후 William Walsh박사가 이 이론을 계승하면서 일부 히스타민 이론에 대해서는 한계를 인정하고 후성유전체 이론을 보완하여 설명하고 있다.
Abram Hoffer박사가 조현증 환자한테 주로 처방한 나이아신(B3)이 methyl sponge역할을 한다는 맥락을 이해한다면, 과메틸화 환자에서 좀 더 도움이 되었으리라 유추 할 수 있을 것이다.
Carl Pfeiffer는 1988년 출판한 “Nutrition and Mental Illness:
An Orthomolecular Approach to Balancing Body Chemistry”
와 1970년도작인“The Schizophrenias: Ours To Conquer”에서 조현병의 생화학적 다빈도 원인을 각각 1) histapenia, 2) histadelia, 3) pyroluria로 분류하였다.
그 당시는 유전체학의 발전이 미진하여 대사 물질을 기준삼다 보니 히스타민 과다, 피롤증으로 구분하였다. 이외에도 4)저혈당증, 5)글루텐 밀가루와 대뇌 알레르기 등을 순위권으로 나열하였으며 중금속문제, 특히 구리과다, 메틸화대사에 중요한 지표인 호모스시테인뇨증에 대해서도 언급하였다(Homocysteinuria Masquerades as Schizophrenia).
지금의 시각에서 보면 엉성한 부분도 있겠지만 1970,80년대 당시 검사방법의 한계, 약물치료가 전부인양 하는 의료계의 편파적 태도 등 어려웠을 여건을 생각해 본다면 영양소 불균형이 정신질환과 연관이 있다는 맥락을 짚어낸 것만으로도 상당한 선구안으로 의미 있는 자취를 남긴 것이라 생각된다.
지금은 현저히 발전한 유전체학에 힘입어 William Walsh박사는 당시 주장들의 많은 부분을 입증해가고 있으며, Amy Yasko, Dr. Jill James, Dr. Richard van Konynenburg, Ben Lynch등 여러 전문가들이 임상에도 활발히 도입하고 있다.
이런 계보 아래, 히스타민이 메틸화 지표로써 충분한 자격을 지니고 있는가에 대해 고찰하고 그 대안은 무엇인가에 관한 고민이 이번 지면의 주제이다.
필자 역시 통합기능의학을 연구하기 시작한 20여 년 전에는 고히스타민혈증 혹은 저히스타민혈증과 정신 증상에 대해 관심이 많아 여러 서적과 자료를 찾아보았지만 명쾌한 설명이 없어 성과 없는 시간들을 제법 겪어야 했다. 앞서 시행착오를 경험한 사람으로서 입문 초심자들에게 조언하자면 히스타민 대사에 관한 이해가 메틸화 생체 지표로써 히스타민의 활용에 선행해야 한다는 것이다.
히스타민 불내성(histamine intolerance)에 대한 연구 결과가 축적 되고 있으며, 나아가 히스타민 과부하(histamine overload)문제로 해석하는 경향이 형성되고 있음을 알고 가자. 히스타민 문제는 히스타민 자체로도 원인이 될 수 있지만, 수산(oxalate), 살리실산(Salicylate), 황산(sulfites), 질산염(nitrites)등과 동시에 문제를 일으킬 수 있다는 걸 인지하고 환자의 생활환경, 섭취하는 음식에 대한 정보를 취합하여 통합기능의학검사를 진행하여야 한다.
다음 그래프는 (From: Histamine and histamine intolerance,
Am J ClinNutr. 2007;85(5):1185-1196.) 히스타민대사를 간략하게 보여 주고 있다.
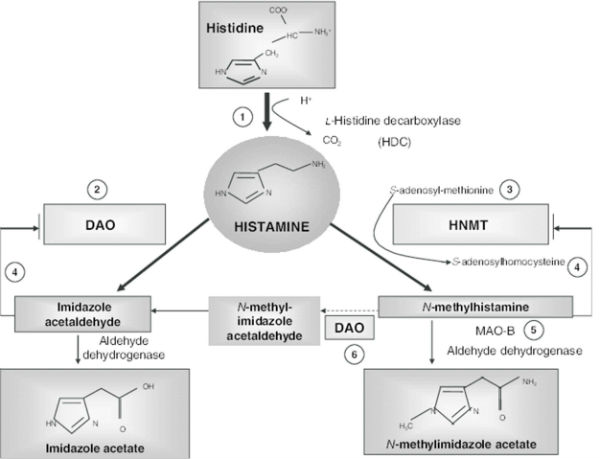
메틸화대사와 직접 연관이 있는 것은 HNMT유전자이지만 히스타민을 분해하는데 관여하는 DAO, MAO-B, ALDH유전자까지 추적해야 메틸화 대사의 큰 그림을 완성할 수 있다. 그래서 메틸공여자를 보충 한다거나 줄이거나 하는 방법만으로는 한계가 있다.
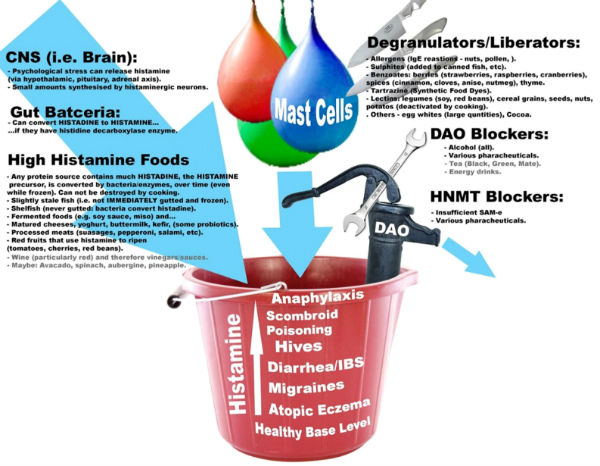
특히 DAO 문제는 Dr. Kevin Conners가 간략하게 제시한 다음 그림과 같이 장내문제, 약물, 섭취한 음식 등 많은 요소를 포함하고 있어 자세한 병력과 다른 통합기능의학 검사를 시행하여야 알 수 있다.
메틸화 대사문제를 조기에 인지하려면 다음과 같은 통합기능의학적 사고를 할 수 있어야 한다.
1) 통상 기존검사에서 메틸화 대사 장애를 의심하는 생활습관 요인, 이학적 검사, 통상적으로 시행하는 일반혈액검사, 위내시경 등에서 유추할 수 있다.
메틸화 과정에 부정적 결과를 가져오는 8가지 요인
1. 유전: 우리들 중 20%정도가 유전적으로 높은 수치의 호모시스테인을 가지고 있다.
2. 바람직하지 못한 식사
3. 흡연: 담배의 일산화탄소 성분은 비타민 B6를 불활성화 시킨다.
4. 흡수불량: 소화기 질환, 음식알레르기 노화
5. 위산의 감소
6. 약: 제산제, methotrexate(암, 관절염, 자가면역질환약), 경구피임제, hydrochlorothiazide(고혈압 약), Dilantin(간질약) 등이 비타민 B군 결핍에 영향을 준다.
7. 몸 상태의 변화: 갑상선기능 저하증, 신부전, 하나의 신장, 암, 임신 등
8. 독성에의 노출: 비타민 생성을 방해하는 몇 가지 독성 등이 있다.
메틸화대사 장애 여부를 판단하는 수단에는, 간접적으로 알 수 있는 간단한 검사방법과 유전자 검사로 직접 알아내는 방법이 있다.
1. 영양신체검사:
a. 입: 구순구각염, 입술 주위 및 입가의 갈라짐
b. 혀: 탈유두화(유두의 위축 및 부재) 혀의 좌우 바깥 모서리
c. 불안/긴장 반응 증상: 임상적으로 부족 시 비타민 B 부족 때문일 수도 있다.
2. 일반혈액검사: 거대적혈구나 빈혈은 부실한 메틸화 대사의 징후이다. 90이상의 적혈구(MCV) 수치는 메틸화문제를 시사한다.
3. 내시경검사에서 위축성 위염인 경우 저위산증 의심
4. 호모시스테인: 호모시스테인은 일반적으로 5.9-16μmol/L를 정상 범위로 설정하지만, 통합기능의학적으로는 7-8μmol/L정도를 최적의 상태로 간주하고 진료를 하길 추천한다.
2) 유전체학이 발전하기 전에는 Methionine, SAM, SAH, Cysteine, Cystathione 대사산물 등을 동시에 검사하고 SAM/SAH비율을 보고 메틸화대사 정도를 알아보는 방법이 쓰였다. 상기에 서술한 3가지 이론에 보완하여 참고할 수 있을 것이다.
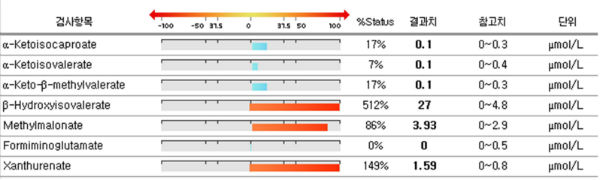
3) 또한 유기산검사에서 FIGLU, MMA를 보고 메틸화 대사 정도를 추정하기도 한다.
4) 메틸화대사유전자 특히 메틸화대사와 연관된 단일 염기다형성(SNPs)을 응용한 DNA NUTRIGENOMIC TEST를 2005년도 Amy Yasko 등이 정신질환 환아에 도입하여 나름의 의미 있는 성과를 거두었다. 그 이후, 유전체 검사비용이 떨어지고 소요 시간도 단축됨에 따라 많은 후학들이 성장하고 검사 회사도 해가 다르게 발전하고 있다.
- 유전체검사도 영역이 나뉘어져 있는데 중 주로 sequencing을 하여 raw data를 분석(interpretation)해주는 회사에는 Genos Research, 23andme, ancestry.com등이 있고, 이를 토대로 처방(Intervention)을 해주는 회사에는 Strategene X, MTHFRsupport, Promethase, Opus23, Livewello, Selfdecode, Nutrigenomi, Xcode, Functional genomic analysis등이 있으며, 이외에도 많은 신생회사들이 세워지고 있다.
여기서 유념해야 할 사실은 “Dr. Amy” Yasko’s Autism Protocol: Unproven, Complicated and Expensive” 라며 비판적인 시각도 있음을 의식하고 통합기능의학을 시도하는 임상가들은 더욱 철저히 공부하고 증명해가며 진료를 해야 한다는 점이다. MD저널 2018년 6월호에 기고한 CBS(Cystathione Beta Synthase) debate도 Yasko의 초기 해석이 잘못되어 초래한 일면이 있다. 통합기능의학은 아직 주변부 의학이기 때문에 무수히 행해진 결과 간략한 통법으로 정리되어 굴러가는 프로토콜의학과는 차원이 다르다. 특히 납득은 안 되지만 “심평의학”의 기준으로 책에서 배운 의학과 현실의 의학을 괴리시키는 대한민국 의료계라면 더욱 그러하다.
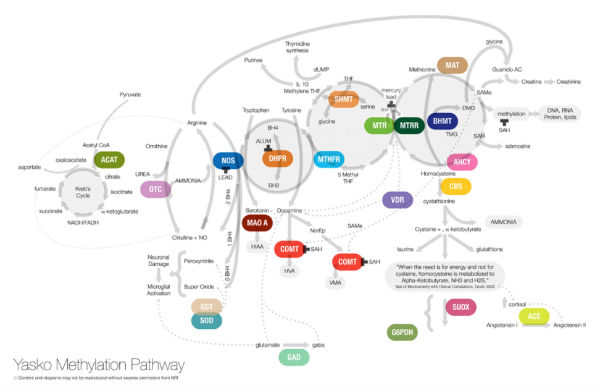
- 다음 그림은 Yasko가 제작해 배포한 메틸화 대사 모식도이다. 메틸화 대사를 이해하려면 기본으로 알아두고 메틸화 연관된 유전자, 유전자 변이를 암기해야만 제대로 된 처방을 할 수 있게 될 것이다.
-그래서 오용이나 남용을 막기 위해서 왈쉬연구소에서는 의사자격을 가진 임상가 만이 수강을 하도록 제한하고 있다(WALSH RESEARCH INSTITUTE - Mastering Brain Chemistry:
Bio-Balance Health Please note that spaces are limited to licensed,
practicing doctors holding an MD or DO degree.
Nurse Practitioners and Physician Assistants may attend with their supervising physician).
- 여러 독자들이 꼭 알아야 할 것은 정해진 프로토콜은 아직 없다는 것이다. 임상가마다 약간씩 차이가 있지만 핵심은 통합기능의학의 기본 패러다임과 원칙을 이해하는 임상가가 후성 유전체학, 영양 유전체학을 연구할 때 큰 시너지를 얻을 수 있다는 점이다.
5) 환자의 메틸화 대사를 측정하는 데 한 가지 방법으로는 전체 상황을 이해하기가 쉽지 않다. 그래서 최근에는 호르몬, 유기산검사, 유전체 등을 동시에 검사하여 각 검사법의 한계를 상호적으로 보완할 수 있는 유용한 수단으로 DUTCH검사법이 인기를 끌고 있다.
<다음호에 계속>

