[엠디저널]알츠하이머는 퇴행성 뇌 질환의 노화로 인해 진행되는 질병 중 가장 흔한 질환으로 미국에서 550만 명을 비롯하여 전 세계에서 약 4,400만 명 정도가 이 질환으로 고통을 받고 있으며, 의학계는 그 숫자가 2050년까지 3배가 될 것으로 추산하고 있다. 21세기 질환이라고 불리는 알츠하이머는 개인과 가족뿐만 아니라 국가 전체의 사회 안전망을 송두리째 무너뜨리는 인류의 재앙으로 받아들일 만큼 심각한 질병이다. 60세 이상의 노인들에게 있어서 뇌졸중, 근골격계 질환, 심혈관계 질환에 더하여 알츠하이머는 암보다 더 두려운 질병이다.
불행히도 현재 알츠하이머 또는 다른 신경 퇴행성 장애의 진행을 멈추거나 역전시킬 수 있는 치료법이 없다는 것이 환자들을 더욱 불안과 공포로 떨고 있다. 이처럼 수많은 사람들에게 고통을 안겨주고 있는 알츠하이머는 그 치료제 개발이 시급하지만 현재까지 치료제 개발의 99.9%가 실패로 끝났으며, 이처럼 알츠하이머 치료제의 신약개발을 어렵게 만드는 가장 큰 이유는 그 병인이 너무 다양하고 복잡하여 정확한 원인을 찾기 어렵기 때문이다.
알츠하이머의 원인은 아직까지 정확히 알려지지 않았지만, 일부 알츠하이머 환자의 뇌에 뇌 주변의 신호를 전달하는 역할을 하는 화학적 메신저인 아세틸콜린과 같은 물질이 부족할 때, 이러한 신호가 효과적으로 전달되지 않는다는 점을 타겟으로 개발되어진 약물들이 현재 사용되고 있지만 질병의 중증으로의 진행을 전혀 막지 못하고 있는 실정이다.
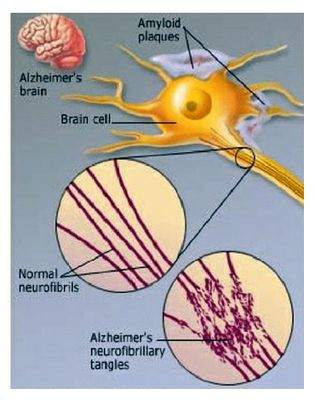
알츠하이머의 주 병리학적 원인은 β-아밀로이드(β-amyloid, Aβ) 응집에 인해 생성된 노인성 반점(senile plaque)와 인산화 타우(phosphorylated tau) 응집에 의해 생성된 신경섬유 다발(NFT)이라고 추측되며, 이러한 Aβ의 축척은 염증을 유발하고, 염증 반응은 미세아교세포를 자극하여 산화적 스트레스를 발생하며 미토콘드리아 손상을 유발하여 신경세포 사멸을 진행시킨다. 신경섬유다발은 Aβ oligomer(OAβ)에 의한 신경접합부의 손상을 가중시켜 인지능력 저하를 유발한다. 현재까지 알려진 알츠하이머의 병인은 β-아밀로이드(Aβ)로써 과생성된 Aβ에 의한 신경세포 손상이 여러 원인 중 하나의 대표적인 원인으로 떠오르고 있다(그림 1). 따라서 인지 기능 저하는 Aβ 농도에 비례한다는 주장이 대세이다.
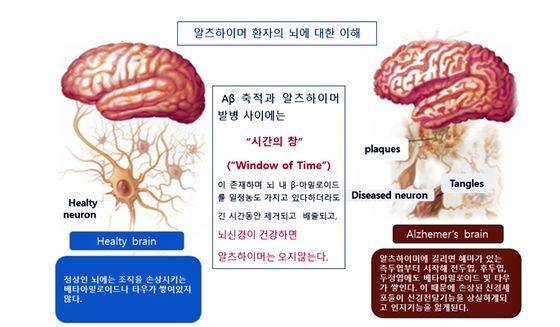
다른 한편, 일부 임상연구에 따르면 인지 기능 저하는 Aβ 농도의 변화와 거의 연관성이 없으며, Aβ 축적과 알츠하이머 발병 사이에는 “시간의 창”(window of time)이 존재한다는 것이다. 다시 말하면 알츠하이머가 중증으로 발현되기까지는 반드시 일정기간이 필요하다는 것이다(그림 2). 알츠하이머는 증상이 나타나기 적어도 20여 년 전부터 뇌에 β-아밀로이드(Aβ)가 축적되기 시작하고 나중에 언급할 여러 다양한 원인들에 의해 Aβ 생성이 지나치게 많아졌지만 뇌 면역세포(microglia)에 의해 정상적인 제거가 이루어지지 못했을 때, 뇌에 Aβ가 쌓이게 되고 Aβ의 응집물인 plaque는 신경세포말단에서 신경전달물질의 원활한 전달을 방해한다. 시간이 지나면서 가용성 독성 Aβ 올리고머(OAβ)가 신경세포 내부로 침투하고 침투한 OAβ는 타우 단백질을 과인산화하여 tangle을 생성하며, 이러한 과인산화된 타우의 축적으로 신경섬유다발(NTF)이 생성되고 신경세포 내부 골격을 잡고 있는 타우의 붕괴로 신경세포가 사멸된다. 알츠하이머 환자들은 대부분 뇌에 Aβ가 축적되어 있지만 모르는 채로 초기상황을 지나치게 되어 인지기능 상실로 이어지며, 어느새 가장 심각한 상황에 처한 자신과 마주하게 된다.
알츠하이머는 질병이 발현되고 진행되는 과정 속에는 간단하게 한 가지 원인만으로 결론지을 수 없는 복잡한 원인들이 내재하고 있으며 따라서 질병이 심각한 양상으로 발현되기 이전에 조기치료의 중요성에 대해 강조하고자한다. 알츠하이머 신약 개발 라인 중 이미 중증으로 진행된 알츠하이머 환자의 치료약인 타우 단백질 억제제의 3상 임상 결과가 거의 성공 확률이 없다는 점을 보더라도 알츠하이머는 오랜 기간 진행된 환자의 경우 치료가 어렵다는 것을 미루어 짐작할 수 있다.
흔히 단기 기억상실의 증상을 단순히 노화에 따르는 흔한 건망증 정도로 간주하고 방관하고 지나치는 경우가 대부분이지만, 손 놓고 앉아 있기에는 뒤따라오는 “알츠하이머”라는 태풍의 그 후속여파가 너무 무서운 결과로 들이닥치기 때문에 방치된 알츠하이머 초기 환자를 잘 관찰하여 중증으로 가는 길을 막는 방법에 최근 관심이 집중되고 있다.
다양한 원인에 따른 치매의 발생 기전
현재까지 알려진 알츠하이머의 대표적인 병인은 노인 치매는 인지능력 저하를 수반하는 노인성 질환으로 최근 수십 년간 연구가 지속되어 오고 있지만 정확한 병리 기전은 확정된 것이 없다. 전 세계적으로 약 5천만 명 이상의 치매 환자가 존재하는 것으로 알려져 있으며 유병률은 증가하고 있다. 이 중에서 알츠하이머가 전체 치매환자의 약 60%의 비율을 차지하고, 혈관성치매 약 20%, 루이소체치매 약 10%, 전두측두엽치매가 약 2% 비율을 차지하고 있으며 이들이 치매의 일반적인 형태로 알려져 있다(그림 3).
혈관성치매(Vascular dementia)는 뇌혈관 질환에 의해 뇌조직이 손상을 입어 치매가 발생하는 경우로 뇌 내 혈액순환이 저하되어 저산소성 손상과 산화적 스트레스가 증가되어 염증 반응을 유발하고 혈관 및 신경세포의 손상으로 인해 발생한다고 알려져 있다. 최근에는 치매뿐만 아니라 치매보다 경미한 인지기능장애까지 포함하는 개념으로 혈관성 인지장애(vascular cognitive impairment)라는 용어가 사용되기도 한다.
루이소체치매(Dementia with Lewy bodies, DLB)는 시간이 지나면 상태가 악화되는 신경퇴행성(neurodegenerative) 뇌질환으로 α-시누클레인(synuclein) 응집체인 루이소체가 축적되는 희귀한 뇌 질환이며 자칫 파칸슨병이나 알츠하이머로 잘못 진단될 가능성이 많지만 구분되어야 한다. 비정상적으로 응집된 신경섬유단백질인 루이소체의 생성과 밀접한 관련이 있고, 산화적 스트레스와 α-시누클레인의 축척이 미토콘드리아에 손상을 주어 루이소체가 뇌전체부위에 산발적으로 생성이 되어 발생된다.
전두측두엽치매(Frontotemporal dementia, FTD)는 전두엽 및 측두엽의 위축으로 인해 발생하는 전형적인 행동장애 신경퇴행성 질환으로 다른 치매보다 병의 시작이 이른 것이 특징이며 주로 65세 이하에서 발병되고 통상 35세~75세에서 발현된다. 유전적 소인과 그 밖의 여러 병리적 소인에 의해 진행된다.
알콜성치매(Alcohol- related dementia, ARD)는 오랫동안 알코올성 주류를 과도하게 섭취하여 발생하게 되는 치매로 기억을 포함한 지적기능에 총체적인 약화를 초래하게 되며 전두엽(frontal lobe)의 손상으로 인한 억제기능상실(disinhibition), 자신들의 행동으로 오는 결과에 대한 무시(disregard for the consequence of their behavior)등 신경학적 손상과 인지기능장애 등의 일반적인 치매증세와 코르사코프 증후군(Korsakoff’s syndrom)의 정신과적인 증상 모두를 보이게 된다. 또한 소뇌(cerebellum)에 손상을 주어 소뇌실조증(cerebellar ataxia)을 일으키게 되어 사지감각에 이상을 보이며 걸음걸이도 불안하게 되고, 우울증에 걸릴 확률도 높아진다.
알츠하이머는 아직까지 완벽한 원인은 여전히 밝혀지지 않았지만, Aβ의 응집물인 plaque와 과산화된 타우의 침착물인 신경섬유다발(NTF)을 주원인으로 지목하고 있다.
알츠하이머의 종류에 따른 발생빈도
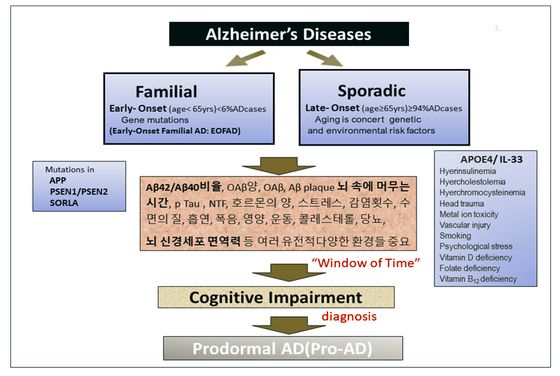
연구에 의하면 알츠하이머는 가족 내에서 발현될 수 있으며, 이를 가족력 알츠하이머(familial Alzheimer’s disease, FAD)라고 하며, 가족력에 의한 알츠하이머는 환자 중 극히 일부에서 발병한다. 또한 알츠하이머 환자의 대부분의 경우 유전이나 가족력에 관계없는 것처럼 보이며, 이런 경우를 산발성 알츠하이머(sporadic Alzheimer’s disease, SAD)라 한다.
FAD는 SAD와 병원성 서열이 매우 다르다는 것과 아밀로이드 축적으로 시작한다는 증거가 없다는 점이 강조된다. 따라서 AD의 유전적 기초는 질병의 가족 형태에만 적용된다. 일반적으로 초로기(조발성) 알츠하이머(early onset Alzheimer’s disease, EOAD)는 65세 이전 발병으로 규정하고 대부분 가족력과 관계가 있으며, 조사결과 가족력을 가진 초로기 알츠하이머는 총 알츠하이머 환자의 1% 미만에 불과하다. 노년기(만발성) 알츠하이머(late onset Alzheimer’s disease, LOAD)는 65세 이후 발병으로 규정하며 대부분 정확한 원인을 모르거나 너무나 다양한 원인을 가지고 있는 산발적 알츠하이머(sporadic Alzheimer’s disease, SAD)와 연관이 있으며 우리가 일컫는 대부분의 알츠하이머에 해당된다.
프레세닐린1,2(PSEN1,2) 돌연변이 유전자는 Aβ(1-42): Aβ(1-40)의 비율을 높이며 FAD를 유발한다. 따라서 FAD에 대한 많은 연구가 γ-세크레타제를 암호화하는 유전자의 돌연변이에 초점을 맞추고 있다. 그렇지만 불완전한 가족력은 알츠하이머의 유전적 위험을 평가하는 데 중요한 장애물이 될 수 있으며, 개인이나 가족의 유전적 위험을 평가하려면 질병이 진행된 가족의 알츠하이머 진단과 발병 연령에 관한 가능한 한 많은 정보를 가지고 정확한 가족력을 얻는 것이 중요하다. 하지만, 형제가 없거나 형제, 자매의 건강 상태에 관한 정보가 없을 수도 있어 가족력 알츠하이머에 대한 신뢰할만한 답을 얻는 것은 생각만큼 쉽지 않다.
조기치료의 중요성
일반적으로 알츠하이머 초기 증상으로 꼽히는 것은 바로 건망증으로 살면서 누구나 겪을 수 있는 증상 중 하나가 건망증이지만, 나이를 먹어가면서 횟수가 잦아지면 알츠하이머의 초기 증상 여부를 의심해봐야 한다. 특히 최근의 사건을 기억하기가 어렵다는 단기기억상실(short term memory loss)은 알츠하이머의 초기 증상 중 가장 흔한 증상이다. 알츠하이머 유전자가 있다고 하여 모두 알츠하이머에 걸리지는 않기 때문에 질병 발병 이전에 예방에 집중하는 것이 중요하며, 발병하였다하더라도 이를 조기에 발견하여 중증으로 가는 것을 미연에 방지하는 것이 알츠하이머 치료의 가장 중요한 포인트이다. 따라서 조기 진단이 알츠하이머를 예방할 수 있는 가장 중요한 목표가 될 수 있다. 알츠하이머는 식습관, 운동 등의 환경적인 요소에 따라 발병이 좌우되는 경우가 더 많기 때문에 질환을 예방하는 것이 절대적으로 중요하며, 조기진단과 조기치료가 그 어떤 질병보다 더 강하게 요구되는 질환이다. 알츠하이머의 조기 진단 및 예방을 겨냥한 조기치료가 주목받으면서 관련 산업도 급속도로 커지고 있으며, 조기치료를 목표로 할 경우 조기진단은 매우 중요한 필수 사항으로 자리 잡을 수 있다. 혈액, 소변, 침 등으로 알츠하이머를 간편하게 조기 진단할 수 있는 기술이 개발된다면 치료제 개발만큼이나 가치 있는 일이라 할 수 있다.
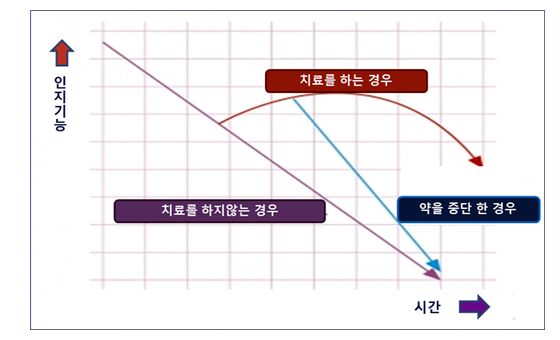
일반적인 건망증과 알츠하이머의 차이가 있다면 알츠하이머는 잊어버린 것에 대해 힌트를 주었을 때 기억해내지 못한다는 것이다. 힌트를 주어도 기억해 내지 못하면 알츠하이머를 의심해야 한다. 알츠하이머가 발병했다고 해서 모두 기억을 잃고 중증 알츠하이머로 곧바로 직행하는 것이 아니기 때문에, 더 이상 질병을 진행시키지 않고 정상적인 생활을 가능하게 되돌릴 수 있다는 점에서 조기치료의 중요성을 강조하고 있다(그림4).
국립고령화연구소 및 알츠하이머협회(National Institute of Aging and Alzheimer‘s Association, NIA-AA)는 MCI와 Pre-AD를 포함한 새로운 알츠하이머의 조기진단기준을 발표하였으며, FDA는 MCI와 Pro-AD 환자를 대상으로 임상2상 효능과 안전성에 성공한 신약들에 대해 시판 후 3상 임상성적표를 내도록하는 선허가제(fast track)를 전격 도입하였다. 이는 고령화 사회로 접어들면서 알츠하이머 환자가 급속도로 늘어나고 있으며, 증상을 완화하는 처방약 이외에 아직 마땅한 치료법이 없는 현재 상황에서 FDA가 알츠하이머 초기단계의 많은 환자들을 위해 이들이 중증으로 가기 전에 좀 더 일찍 치료약을 투약하여 조기치료의 기회를 주기 위하여 결정한 제도로 알츠하이머는 “조기진단과 치료”라는 결론을 얻었다고 해석할 수 있다.
조기진단의 중대한 가치
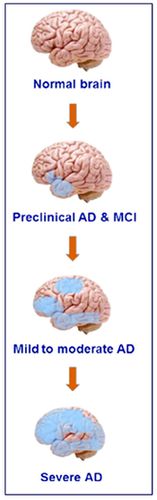
알츠하이머는 보통 천천히 시작하여 시간이 지남에 따라 악화되는 만성신경퇴행성질환(chronic neurodegenerative disease)으로 알츠하이머로 발전하기 전 단계를 경도인지장애(mild cognitive impairment, MCI)라고 하고, 신경과에서는 경도인지장애의 전 단계가 주관적 기억장애(subjective cognitive decline, SCD)일 수도 있다고 본다. 일단 단순한 건망증이라고 넘길 수 있는 전임상 알츠하이머(Pre-AD)과정을 지나 스스로 자신의 인지기능에 문제가 있다고 인지하며 의혹을 품기 시작하는 주관적 기억장애(SCD)는 경도인지장애(MCI)를 지나 알츠하이머로 가는 과정이라고 볼 수 있다.
과거에는 알츠하이머 초기 환자를 정확히 진단해내기가 무척 어려웠다. 환자의 변화된 뇌 조직의 관찰은 환자가 사망한 후에나 가능했기 때문이다. 이후 알츠하이머가 Aβ 단백질과 관련이 높다는 사실이 알려지면서 뇌척수액 검사가 권장되었지만, 뇌 속 Aβ 단백질의 농도를 알기 위해 환자 척수에 직접 주사를 꽂아 채취해야 하므로 권장하기 쉽지 않았다. 그러나 최근 ‘아밀로이드 PET-CT’가 등장하면서 Aβ 단백질의 농도 측정이 가능한 CT 장비를 통해 뇌의 상태를 손쉽게 알 수 있게 되었다. PET-CT의 임상 적용으로 기억력이 떨어진 노년기 환자들을 조기에 진단 가능해진 것이 가장 큰 장점이며, 진찰 과정도 간단하여 PET-CT 검사와 함께 의료진이 환자를 대면해 신경심리검사를 진행하면 알츠하이머는 비교적 정확하게 진단할 수 있다.
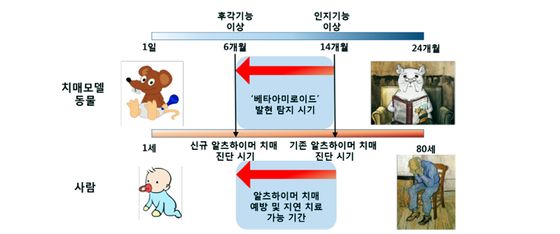
또한 최근 콧물을 이용해 치매를 진단할 수 있는 시스템에 대한 기술 이전이 추진 중이며, 이 기술이 상용화 될 경우, 뇌 영상 진단 소요비용 대비 저가이면서 간단하고 보다 더 빠른 치매조기 진단을 할 수 있게 되어 가정용이나 휴대용 진단키트로도 활용도가 높을 것으로 기대된다. 이는 중추신경계에서만 발현한다고 알려진 β-아밀로이드가 말초신경계인 후각상피조직에서도 발현하는 것을 관찰하여 β-아밀로이드가 후각상피 속 후각신경세포에 치명적인 영향을 끼쳐 직접적으로 후각 기능 상실을 유도한다는 사실을 확인함으로서 최근 알츠하이머와 후각능력 감퇴 간의 연관성에 대해 보고한 바 있다(그림 5).
글리코영양소의 뇌에서의 대화(cell to cell communication)
글라이코실화(glycosylation)는 단백질의 번역 후 변형의 가장 흔하고 가장 복잡한 형태 중 하나로 오늘날 다양한 글리코실화 경로(glycosylation pathways)의 결핍으로 인해 발생하는 희귀한 인간 유전 질환은 100개가 넘는다. 이러한 질환의 대부분은 주로 중추신경계에 영향을 미치며, 또한 말초 신경계에도 장애를 준다. 환자는 전형적으로 발달 지연, 지적 장애, 저혈압, 발작, 신경 병증 및 여러 장기 시스템의 대사 이상을 가지고 있다. 이 질환들 사이에는 모든 세포 유형이 단백질과 지질을 차별적으로 글리코실화하기 때문에 환자들은 세포 신호(cell signaling), 세포 - 세포 상호 작용(cell-cell interaction) 및 세포 이동(cell migration)을 포함한 수많은 과정을 겪고 있는 수백 가지의 잘못된 당화 생성물(mis-glycosylated products)을 가지고 있다.
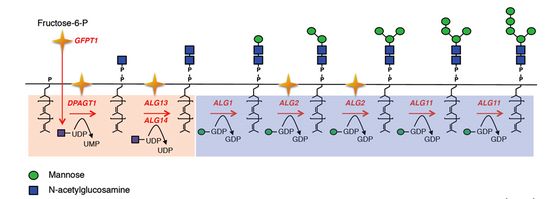
O-GlcNAc Glycosylation (O-linked β-N-acetylglucosamine glycosylation)의 번역후 변형(posttranslational modification)은 우리 뇌의 수천 개의 세포 내 단백질에 존재한다. 특정 생리적 및 질병 상황에서 변화하는 O-GlcNAcation 사건을 밝히는 새로운 접근법은 신경 보호, 신경 신호 전달, 학습 및 기억 및 신경 퇴행성 질병에서의 역할을 포함하여 뇌에서 O-GlcNAc의 조절 기능에 대한 중요한 열쇠를 제공한다. 글리칸의 8가지의 단당류복합조성물이 생명현상을 푸는 열쇠로서 인체 내에서 나타내는 다양한 생리활성들이 복합원인질환(암 및 퇴행성 질환 등)의 증상 개선에 전략이 될 수 있듯이 글리코영양소의 뇌에서의 대화(cell to cell communication) 장애 개선에 대해 알츠하이머의 새로운 예방물질로서의 역할에 대해 이해하고 알츠하이머의 초기증세에 진입한 후에도 뇌의 정상적인 신호체계를 되찾아줄 수 있는 글리코영양소의 영영학적 가치에 대해 한번 더 귀를 기울여 보기를 간절히 소망한다.

