[엠디저널] 알츠하이머는 30대 이후부터 오랜 세월동안 우리 몸의 지휘 기관인 뇌가 수많은 대화 오류로 생긴 뇌 속의 쓰레기 단백질인 Aβ가 청소되지 못하고 남아서 오는 질환이다.
우리 몸에는 60~100조 개의 세포가 있으며 뇌에 존재하는 1000억 개가 넘는 신경세포들은 끊임없이 새로 생성되고 사멸된다. 제 역할을 마치고 수명이 다한 세포는 뇌의 면역에 의해 제거되어야 하며, 우리 몸은 인체 보호 시스템으로 세포자살(apoptosis)을 유도해서 재활용 에너지로 사용한다. 병들고 잘못된 유전자를 가진 세포 또한 면역세포가 제거해 주어야 건강한 뇌를 유지할 수 있다. 우리 몸은 신경세포의 생성 과정과 파괴 과정이 균형을 이루어야 하며, 생명을 위협하는 심각한 질환은 대개 이러한 균형이 깨졌을 때 생긴다. 뇌세포는 흥분성 뉴런(excitatory neuron)과 억제성 뉴런(inhibitory neuron)이 항상 균형을 유지하여 우리 몸을 신경염증으로부터 보호한다. 뇌세포간의 대화(cell to cell communication)의 오류로 흥분성 뉴런과 억제성 뉴런의 균형이 깨지면서 인지기능의 이상이 생기며, 알츠하이머는 30대 이후부터 오랜 세월동안 우리 몸의 지휘기관인 뇌가 수많은 대화 오류로 생긴 뇌 속의 쓰레기 단백질인 β-아밀로이드(Aβ)가 청소되지 못하고 남아서 오는 질환이다(그림1).
뇌 내 청소되지 못하고 쌓인 Aβ의 농도증가로 인해 응집된 Aβ oligomer가 뇌신경 세포사멸을 유도하고 더불어 뇌의 중요한 기능저하로 이어지게 된다. 최근 독성이 가장 큰 Aβ(1-42) oligomer가 알츠하이머 중요한 위험요인으로 주목받고 있다.
Microglia의 기능
미세아교세포(Microglia)는 뇌의 면역과 청소기능을 담당하는 세포로서, 시냅스 재구성 및 성숙 등 CNS 발달, 항상성의 유지 및 퇴행성 질환에 관여하는 것으로 알려져 있다. 또한 신경세포 주변을 돌며 면역 위협과 같은 환경변화에 신속하게 대응할 수 있다. 일단 적군을 감지하면 Microglia는 제시된 위협을 제거하기 위해 형태학적 변화를 겪고 아메바 형태를 띠며 식세포로 변화한다. 염증조건에서 Microglia는 이러한 형태학적인 변화로 astrocyte 및 말초면역 세포와 통신하는 것을 돕는 cytokine 및 chemokine과 같은 염증 분자의 발현 및 분비를 동반하게 된다. 이 세포들은 또한 P2RY12와 같은 특정 마커를 분비시켜 뇌의 다른 세포들과 말초면역 세포와도 구분된다(그림2).
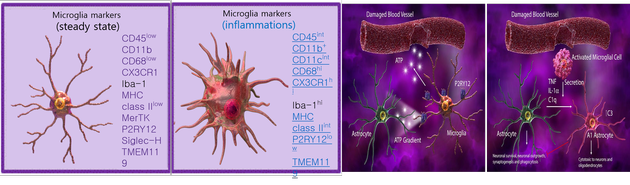
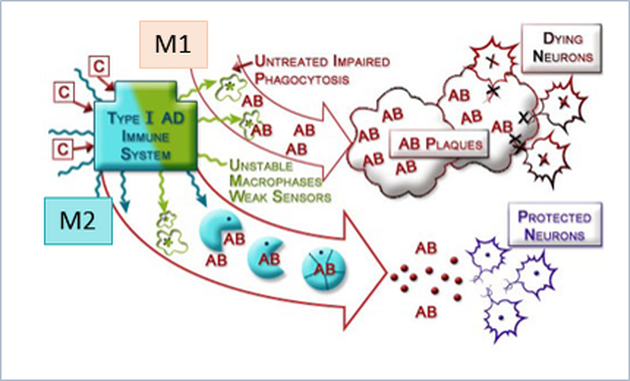
일반적으로 알려진 Microglia의 표현형은 항염증성 표현형인 M2와 염증성 표현형인 M1이 있다. 뇌 면역세포인 M2는 식세포 작용에 의해 Aβ를 제거하여야 하지만 M1은 Aβ나 다른 염증성원인들에 의해 자극되고 과활성화되어 전염증성 cytokine을 분비시키고 오히려 뇌 염증을 유발시킨다. 우리 뇌는 불리한 환경이 생기면 뇌 신경세포는 염증성 사이토카인을 분비하여 시냅스를 흥분시켜 위기를 알리고 뇌에 있는 신경세포와 다양한 신경아교세포의 상호관계가 중요한 역할로 작용한다. 뇌 신경계의 구조적 변화가 일어나기 전이라 할지라도 IL-1β, TNF-α 및 기타 cytokine은 신경 기능을 손상시킬 수 있다. 이와 같은 현상은 추가적인 cytokine, chemokine 및 선천성 면역 수용체(innate immune receptor)인 TLR가 증가되어 나타날 뿐만 아니라 이들의 다양한 상호 작용은 알츠하이머에서 M1활성상태를 발현시킨다. 또한, 선천성 면역기능을 가진 TLR(toll-like receptor)은 TNF-α와 MIP-1α 농도를 상승시키는 역할을 한다(그림3).
Microglia의 오토파지(autophagy)
미세아교세포(Microglia)는 알츠하이머와 같은 신경 퇴행성 질환에서 중요한 역할을 담당하고 있다. 지금까지 Microglia는 신경 염증 및 신경 독성 분자의 방출로 제한된 기능을 가진 신경 퇴행의 조절 인자로 알려져 왔다. 그러나 신경 세포, 특히 시냅스 구조물의 식균 작용을 촉진시킴으로써 알츠하이머에서 관찰되는 인지 능력상실 등의 신경퇴행에서의 Microglia의 역할의 중요성이 높아지고 있다.
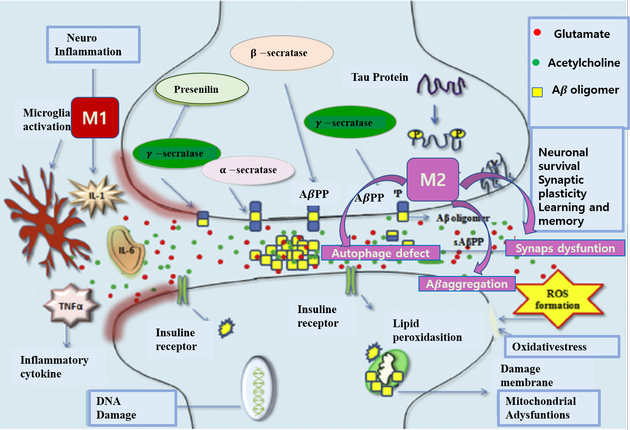
Microglia의 오토파지(Autophagy)는 알츠하이머 환자의 경우 대부분의 반응이 Aβ 단백질과 연관이 있지만, Aβ와 상관없이 독립적으로 일어날 수 있다. 오토파지(Autophagy)는 세포자가포식작용(autophagocytosis)으로써 외부의 스트레스에 반응하여 세포 스스로가 생존을 위해 세포내 해로운 독성물질이나 외부에서 침입한 병원체를 분해하고, 재활용함으로써 필요한 에너지원을 얻는 과정이다. 대부분의 경우 Aβ plaque의 증가와 함께 astrogliosis 및 microgliosis도 증가하였으며, 항염증성 cytokine인 IL-4의 발현으로 Aβ 침착이 증가된다. 산발적 알츠하이머(sporadic AD, SAD)의 경우, Aβ의 비효율적인 제거가 주요한 원인으로 밝혀졌으며, 증가된 cytokine 농도가 Aβ 식균작용 수용체를 하향 조절함으로써 Microglia의 자가포식능력 (phagocytic capacity)이 결핍된다. 프레세닐린1(presenilin1, PSEN1) 유전자 또한 Aβ의 오토파지의 결핍과 시냅스기능이상으로 Aβ 축적을 증가시킨다. 알츠하이머에서 autophagy의 역할은 세포내 Aβ plaque의 제거일 것으로 추정한다(그림4).
최근 국내 한 연구팀에 의해 염증유도 수용체인 TLR4 수용체에 염증신호 물질이 결합하면 PI3K-AKT라는 하위 신호전달경로가 활성화되고, 다시 FOXO3라는 전사인자의 작용을 막아 자가포식작용 (phagocytosis)이 억제되는 것을 밝혔으며 자가포식작용이 억제된 미세아교세포는 β-아밀로이드를 분해하는 능력이 현저히 저하된다는 점을 확인했다. 이를 통해 알츠하이머에서 신경염증이 많이 일어나고 미세아교세포가 활성화될 때, Aβ와 같은 독성 물질이 분해되지 않고 쌓이는 이유를 규명했다.
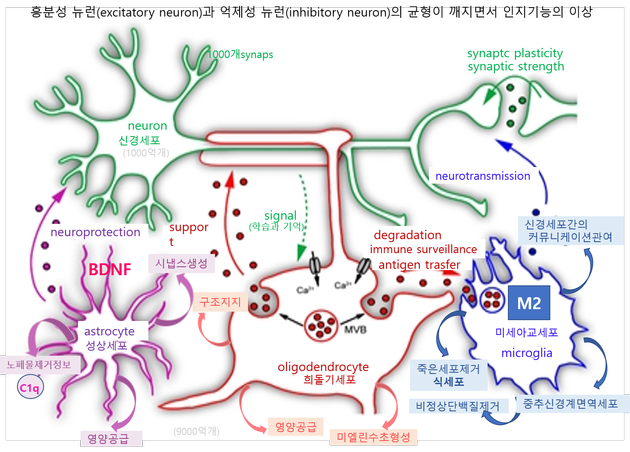
뇌세포간의 대화(Cell to cell communication)
신경아교세포(neuroglia cell)에는 성상교세포(astrocyte), 미세아교세포(microglia), 및 희돌기아교세포(oligodendrocyte)가 있다. 그 중 microglia는 신경세포로부터 분비되어지는 많은 신호들을 받아서 활성화되며 제거(clearance)가 필요한 비정상 단백질이나 죽은 신경세포 등을 제거하는 역할을 하며 신경세포간의 커뮤니케이션(cell to cell communication)에 관여한다. 신경 세포는 하나의 세포가 단독으로 뇌의 기능을 수행하는 것이 아니고 인접한 다른 신경세포들과 시냅스라는 구조를 통해 신호를 주고받음으로써 다양한 정보를 받아들이고 저장하는 기능을 한다. 시냅스는 인접한 두 신경 세포가 연접해 만드는 구조로서 전달된 전기적인 신호는 신경전달물질을 이용해 화학적 신호로 바뀌어 시냅스를 통과하게 된다.
β-아밀로이드(Aβ)는 감염 등에 의한 뇌 내 염증에 대한 보호반응으로 생긴 노폐물로 이를 청소하기 위해 우리의 뇌는 다음과 같은 일련의 과정을 겪게 된다. microglia는 아밀로이드 찌꺼기 제거를 위한 분해효소 분비를 astrocyte에 의뢰하고, astrocyte는 Aβ 분해효소를 분비시키고 이 효소들에 의해 microglia(M2)는 다시 활성화되고 출동된다. 건강한 뇌에서는 Aβ가 생성되더라도 NEP, neprilysin, IDE, ECE등 Aβ분해효소에 의해 분해되고 제거되어진다. 뇌 대사산물인 Aβ가 Aβ의 분해효소 결핍으로 분해, 제거되지 못하고 쌓였을 때. 이것이 플라그로 형성되면 다시 microglia(M1)가 할성화되고 신경염증을 유발하고 신경세포를 괴사시켜 인지력 저하 등의 경과를 거쳐 알츠하이머로 발현된다(그림5). 또한 아밀로이드 플라크는 Aβ(1-42)는 Aβ(1-40)보다 더 끈적거리는 경향으로 잘 응집되기 때문에 Aβ 단백질의 길이가 독성을 결정하며, 반면에 Aβ plaque보다는 dimer형태인 Aβ oligomer가 시냅스 상실의 주원인이다.
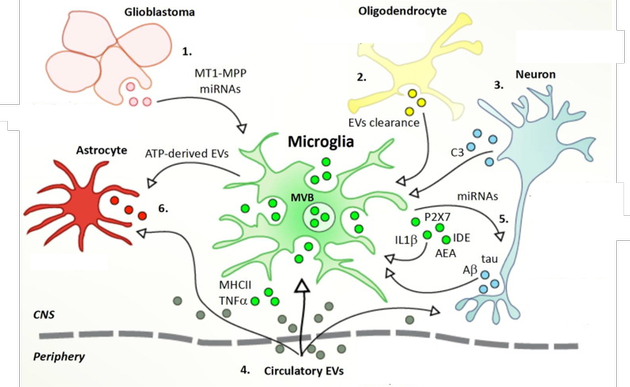
| 다른 기원을 가진 EVs (extracellular vesicles)의 수용세포로서 미세아교세포 : 1. 교모세포종 유래 EVs (glioblastoma-derived EVs)는 미세아교세포 기능을 조절하는 메탈로프로테아제(metalloprotease)를 함유한다. 2. 희돌기신경세포 유래 EVs (oligodendrocyte-derivedEVs)는 미세아교세포(microglia)의 표적이 되어 제거되어진다. 3. C3을 함유하는 신경유래 EVs (Neuronderived EVscontaining C3)는 시냅스 가지치기(synaptic pruning)를촉진 할 수 있다; EVs를 함유하는 β-아밀로이드(Aβ) 및 타우(tau)는 미세아교세포에 의해 흡수 될 수 있다. 4. 순환 EVs (Circulatory EVs)는 CNS에서 우선적으로미세아교세포를 표적으로 삼는다. ATP에 의존하여 분비되는 EV의 근원이 되는 미세아교세포는 miRNA 및 사이토카인을 함유하는 것으로 보여졌으며, 뉴련과 성상세포(astrocyte)를 표적으로 삼는다. 다수의 다른 자극제는 미세아교세포로부터 EVs shedding을 촉진하는 것으로 설명되어진다. |
인슐린분해효소(Insulin-Degrading Enzyme, IDE)
미세아교세포는 식균 작용에 의해 Aβ 섬유를 삼키기 시작한다. 결과적으로, 이들 섬유는 엔도 리소좀 경로로 들어간다. 효소 분해에 주로 내성이 있는 섬유소 Aβ (fibri Aβ)와 달리, 가용성 Aβ (souble Aβ)는 다양한 세포 외 프로테아제에 의해 분해 될 수 있다. 미세아교세포에서는 프로테아제, 네프릴리신 및 인슐린분해효소 (IDE)가 가장 중요하다. 인슐린분해효소(insulin-degrading enzyme, IDE)는 인슐린과 Aβ를 동시에 분해하는 단백분해효소이다. 뇌에 축적된 Aβ는 IDE를 비롯한 뇌 내 아밀로이드 분해효소(NEP, neprilysin, ECE)에 의해 분해 배설되는데, 현대인들의 탄수화물과 설탕의 과잉섭취로 인해 체내에서 IDE가 이미 과잉 소모되어 뇌에서의 쓰일 IDE가 결핍되고, 결국 분해가 덜 되고 남은 Aβ가 축척되고 신경손상으로 이어져 알츠하이머의 발병위험이 커지게 된다. 오토파지(Autophagy)의 일환으로 뇌 대사 노폐물인 Aβ를 분해하는 효소인 인슐린분해효소(insulin-degrading enzyme, IDE)의 감소는 알츠하이머의 새로운 원인으로 조명된다(그림6).
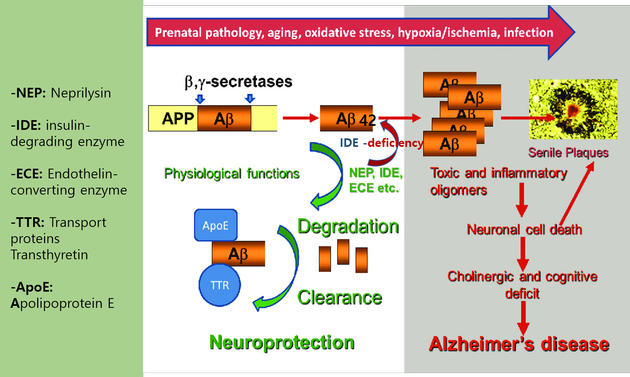
따라서 알츠하이머는 제3형 당뇨, 또는 뇌의 당뇨병이라고도 불린다. 인슐린이 IDE의 수치를 크게 증가시킬 수 있다는 사실은 시험관에서 배양한 뇌신경세포를 이용한 실험을 통해 확인할 수 있었으며, 정상인과 알츠하이머 환자의 뇌조직을 비교한 결과 알츠하이머 환자 뇌조직의 IDE 수치가 감소되어 있다는 사실이 확인되었다. Aβ의 분해에 기여하는 IDE의 주요 공급세포가 뇌의 대부분을 차지하는 성상교세포(astrocyte)이라는 기존 연구결과에 착안하여, astrocyte에 Aβ를 처리하였더니 astrocyte로부터 IDE의 분비가 증가됨을 확인하였다. 이러한 IDE의 분비에는 astrocyte의 자가포식작용(autophagocytosis)과 리소좀(lysosome)이 관여하고 있다.
또한 autophagy의 기능에 중요한 Atg7이라는 유전자를 절반만 존재하게 만든 실험용 마우스와 정상 마우스의 뇌 내에 각각 Aβ를 주입한 후에 뇌척수액의 IDE의 양을 비교한 결과, 오토파지가 제 기능을 못하는 실험용 마우스에 존재하는 IDE의 양이 정상 마우스에 비해 줄어 있음을 확인하였고, 뇌 내의 astrocytes에서 오토파지를 매개로 하여 인슐린 분해효소가 분비되어지는 기전을 밝혔다.
미세아교세포(Microglia)의 면역 이상항진(뇌세포 대화 오류)
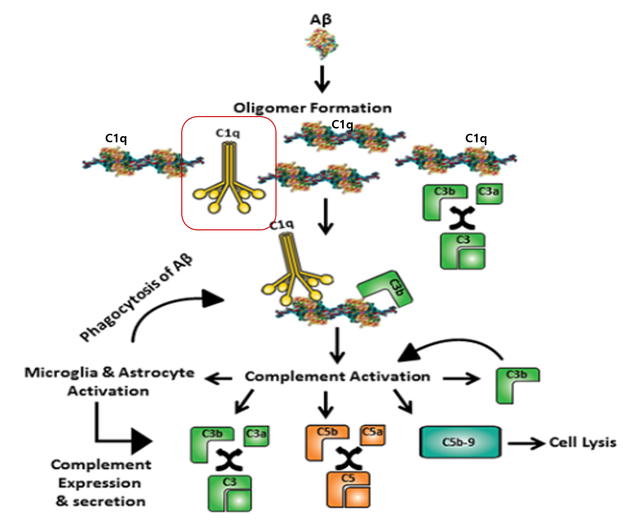
전형적인 보체 경로(classical complement pathway)는 선천성 및 적응성 면역 반응에 필수적인 역할을 하며, 효소 C1r 및 C1s와 결합하여 C1q의 첫 번째 구성요소인 C1을 형성한다. C1q는 비면역글로불린 전형적인 경로(non-immuno globulin classical pathway)에서 활성화제(activators)로 Aβ 단백질에 결합할 수 있으며, 또한 사멸세포와 미토콘드리아, 세포골격 필라멘트(cytoskeletal filaments), 염색질과 같은 손상된 세포에서 방출되는 물질과 결합한다.
C1q결합은 궁극적으로 MAC (membrane attack complex) 형성 및 표적세포를 용해시켜 제거하기 위함이다. 연구 결과에 따르면 Aβ 응집체는 C1q와 C3b에 결합하여 항체 독립적인 구성요소로서 활성화될 수 있으며, C1q-Aβ 침전물은 Aβ를 탐식하고 분해할 뿐만 아니라 활성화된 미세아교세포와 성상교세포로 둘러 싸여 있다. 이러한 염증 반응은 초기에 Aβ 플라크를 제거함으로써 뇌신경세포 보호하기 위함이지만, Aβ 응집체가 더 많이 생성되면 지속적인 보체(complement) 활성화와 염증이 지속되어 뇌신경 건강에 해롭게 작용할 수 있다. C1q를 가진 아밀로이드 침착물이 알츠하이머의 환자 뇌 영역에서 높게 검출되었으며, 따라서 뇌 내 C1q를 포함한 Aβ 플라크는 알츠하이머 병변의 중요한 특징 중의 하나이다.
알츠하이머의 초기 단계에 상응하는 AD 유사 마우스 모델의 pre-plaque 단계에서, 미세아교세포는 인근 시냅스에 C1q이라는 꼬리표를 붙일 수 있으며, Aβ, C1q와 microglia사이의 상호 작용의 결과로 발생하는 잘못된 시냅스 가지치기에 의해 알츠하이머 환자는 플라크 형성에 앞서 시냅스 소실과 인지기능 장애를 일으킬 수 있다(그림7).
면역계의 정상적인 가지치기(pruning)는 자궁 속에서부터 청소년기에 이르기까지 뇌가 성숙하는 동안 미약하거나 불필요한 시냅스를 제거함으로써, 좀 더 중요한 시냅스를 강화해 주는 역할을 한다. 가지치기 과정에서 핵심역할을 수행하는 단백질인 C1q은 성상세포에서 분비되며, 일련의 화학반응을 통해 시냅스에 꼬리표를 붙이고, C1q-꼬리표가 붙은 시냅스를 뇌의 쓰레기청소부인 microglia가 쓰레기처리 과정에서 먹어치운다.
이 과정에서 노폐물인 Aβ plaque를 제거하는 대신에 보호대상인 시냅스와 뇌세포를 파괴하면서 급격하게 질병이 악화되는 상황으로 이어진다. 이때 급격한 인지능력 상실은 Aβ plaque 축적이 아니라, 신경세포간의 대화 오류로 인한 시냅스 상실이며, 알츠하이머의 발병을 증가시키는 특정유전자를 보유한 마우스의 뇌를 분석하여, 알츠하이머의 발병원인이 특히 기억에 관여하는 영역에 나타나는 시냅스 상실임을 밝혔다. 시냅스 상실은 알츠하이머의 일반적인 특징이며 대부분 인지기능 장애 및 인지기능 상실과 깊은 관련이 있다. 당단백다당체(Proteoglycans)는 우리 몸에 유익한 당화된 단백질 (glycosylated protein)이며, 결합 조직에서 발견되는 분자의 한 유형으로 많은 질병에서 치료 가능한 물질로 고려된다. 세포대화수단의 기본이 되는 8가지의 glyconutrient가 조성물특허를 받은 제품으로 M사의 앰브로토스라이프를 손꼽을 수 있다. 신생단백질의 꼬리표가 되는 시알산(N-acetylneuramic acid, sialic acid)을 함유하고 있는 단백질 제품까지 우수한 성분들을 자랑하고 있어 섭취 시 인체 내 유익한 당화된 단백질의 공급원으로서 강력히 추천할 만하다. 당단백다당체(proteoglycans)를 구성할 수 있는 글리코영양소를 미리 섭취하여 뇌세포의 활발한 대화로 알츠하이머의 공포에서 해방되길 바란다.

