[엠디저널 이경호 기자] 한국보건산업진흥원은 국내 연구진이 24시간 주기의 생체리듬을 조절하는 새로운 ‘생체시계 유전자’를 발견했다고 7일 밝혔다. 이 유전자는 루게릭병의 발병 원인과 치료 연구에도 매우 중요한 단서가 될 것으로 전망돼 학계의 관심을 모으고 있다.
이번 연구는 보건복지부·한국보건산업진흥원의 질환극복 기술개발사업(질병중심 중개기반연구) 및 미래창조과학부·한국연구재단의 신진연구지원사업 지원으로 울산과학기술원 임정훈 교수(생명과학부)의 연구로 진행되었으며, 연구 결과는 생화학 및 분자생물학 분야 최고 권위의 학술지 가운데 하나인 ’Molecular Cell’지에 4월6일자로 게재되었다.
Ataxin-2 유전자의 돌연변이는 루게릭병, 척수소뇌실조증, 파킨슨병 등의 중요한 유전적 원인으로 제시되어 왔지만, 노화에 따른 신경세포 사멸과 퇴행성 뇌질환의 발병을 조절하는 분자생물학적 작용 원리에 관해서는 알려진 바가 없다.
연구팀은 핵심기능을 한다고 생각되는 Ataxin-2 복합체와 관련된 유전자 기능을 규명하여 이들이 생체리듬을 조절하는 신경 펩타이드의 일주기성 분비와 수면주기를 지속시키는 시계태엽과 같은 역할을 한다고 밝혔다.
이번 연구결과는 루게릭병과 같은 퇴행성 뇌질환의 발병 원인을 이해하는데 중요한 근본적인 분자생물학적 모델을 확립하고 이를 토대로 향후 루게릭병을 일으키는 위험인자와 작용 원리를 밝혀냄으로써 관련 뇌질환의 예측과 진단, 치료에 매우 중요한 기반 지식이 될 것으로 전망된다.
※루게릭병: 근위축성 측색 경화증으로도 불리며, 운동신경세포가 퇴화하면서 근육쇠약, 호흡장애 등을 일으킴. 환자의 평균 수명이 3-4년 정도이나 현재 개발된 치료제가 없음. 유명 이론물리학자 스티븐 호킹이 투병중 임
※척수소뇌실조증: 유전적 요인에 의해 발생하며, 소뇌가 위축되고 퇴화함에 따라 점진적으로 운동 및 언어능력을 상실함
※파킨슨병: 중뇌 흑질 신경세포의 퇴화와 신경전달물질 도파민 분비 감소에 따라 근육 경직, 떨림, 느린 움직임 등의 점진적인 운동장애가 나타나며, 인지/심리, 치매, 수면장애 등을 수반하기도 함
◆ 논문의 주요 연구내용
유전자 발현은 생명체가 가지고 있는 유전 정보의 암호를 해독하고 이에 따라 생물학적 기능을 가지고 있는 분자들을 생산해내는, 생명현상에 있어 매우 근본적이고 필수적인 생화학적 작용이다. 전사 작용을 통해 DNA로부터 합성된 RNA의 안정성을 제어하거나, 그 단백질 번역을 조절하는 전사 후 유전자 발현 조절은 일주기성 유전자 발현과 동물행동 뿐만 아니라 신경세포의 다양한 생리학적 기능에 있어 매우 중요한 분자생물학적 작용 원리로 새롭게 주목받고 있다.
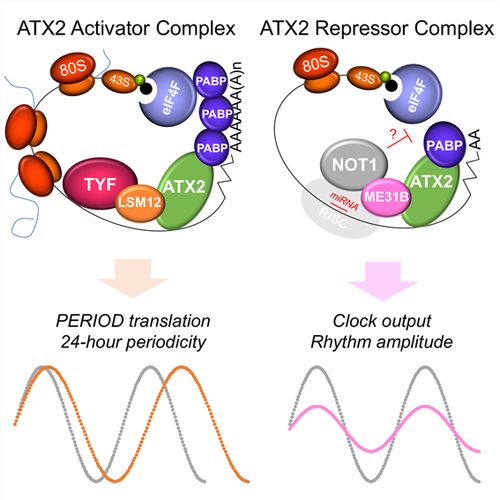
본 연구팀의 선행연구를 통해 밝혀진 RNA 결합 단백질 Ataxin-2의 신경세포 특이적 period 단백질 번역 활성화와 이를 통한 일주기성 동물행동 조절, 그리고 Ataxin-2 유전자의 돌연변이에 의한 퇴행성뇌질환 발생 가능성은 이러한 사실을 뒷받침한다. 하지만 Ataxin-2 단백질이 어떠한 단백질 복합체를 선택적으로 형성하여 그 생리학적 기능을 수행하는지에 관해서는 알려진 바가 없다.
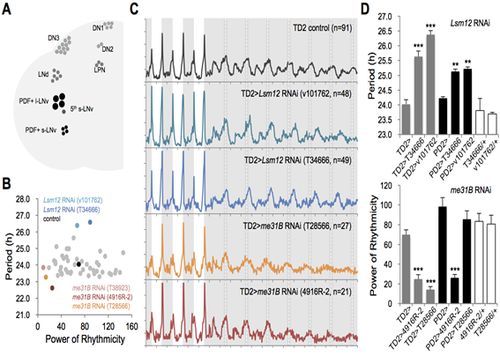
신경세포 특이적으로 작용하는 Ataxin-2의 생리학적 기능을 활용하여, Ataxin-2의 전사후 공활성화 기능에 중요한 새로운 유전자를 탐색하였다. 이를 위해 생체시계 신경세포 내의 RNA 간섭(RNA interference)을 통해 Ataxin-2와 결합할 것으로 예상되는 각 후보 유전자의 발현 저해가 일주기성 동물행동에 미치는 영향을 탐색하였다.
세포 배양을 활용한 전사 후 유전자 발현 조절 실험을 통해 Lsm12는 Ataxin-2 의존적인 twenty-four의 번역 활성화 기능에 특이적으로 필요하나, Ataxin-2와 me31B는 Not1에 의한전사 후 유전자 발현 저해에 특이적으로 필요한 새로운 인자로 확인되었다. 이는 Ataxin-2가 결합하는 단백질 및 RNA의 종류에 따라 전사 후 유전자 발현에 있어 정반대의 기능을 갖는 단백질 복합체를 형성한다는 분자생물학적 증거를 제시하고 있다.
Ataxin-2 단백질 복합체 형성과 기능에 관한 근본적 작동 원리를 최초로 규명하고, 그 진화적 보존성을 증명함으로써 다양한 동물모델에서 해당 단백질 복합체의 분자세포생리학적 기능 연구에 매우 중요한 단서를 제공하였다. 특히 전사 후 유전자 발현 조절 기능에 의한 일주기성 생체리듬 조절의 중요성을 뒷받침하는 새로운 실험적 증거로서, 본 연구를 통해 신경세포 특이적으로 작용하는 두 가지 다른 종류의 Ataxin-2 단백질 복합체와 그 조절 원리를 밝혀냈다.
이러한 연구 결과는 Ataxin-2 단백질 복합체가 어떠한 방식으로 퇴행성뇌질환 발병에 관여할 수 있는지에 관한 매우 중요한 모델을 제시하고 있다. 본 연구팀은 이번 연구를 통해 새롭게 확립된 Ataxin-2 단백질 복합체에 대한 형질전환 동물 모델을 활용하여, Ataxin-2 단백질 복합체에 의한 루게릭병의 발병 원리를 규명하기 위한 후속 연구를 진행 중이다. 이를 통해 루게릭병을 일으키는 위험인자와 작용 원리를 밝혀냄으로써 관련 뇌질환의 예측과 진단, 치료에 매우 중요한 기반 지식을 확립할 수 있을 것으로 전망된다.

